|
Asma
TIPOS DE ASMA
ASMA POR SULFITOS
Segundo a FDA (Food and Drug Administration) uma em cada 100 pessoas é sensível aos sulfitos.1 Estima-se que 3–10% de todos os asmáticos são sensíveis aos sulfitos.2
Os sulfitos são minerais naturais utilizados desde a Antiguidade: os gregos usavam o anidrido sulfuroso para desinfeccionar suas casas (fumigação); os romanos e egípcios os empregavam na sanitização de recipientes destinados ao acondicionamento dos vinhos (ânforas). Como preservativo de alimentos, sua utilização data do século XVII, tendo sido aprovado o seu uso nos EUA no início dos anos 1800.
No âmbito da indústria alimentícia, os conservantes são utilizados para prevenir a deterioração microbiana, enquanto que os antioxidantes são usados para evitar as reações químicas (oxidação) que levam a sabores e/ou odores desagradáveis e descoloração.3
Os sulfitos estão presentes naturalmente em vários alimentos e são utilizados há séculos como potentes agentes redutores para vários produtos nutritivos visando:
• Inibir o processo oxidativo associado com a deterioração dos alimentos (prevenir ou reduzir a perda da cor) em frutas e vegetais como maçã seca, batatas lavadas e desidratadas, para mantê-los com aparência de "frescos" por longos períodos;4
• Prevenir a melanose provocada pela enzima polifenol oxidase em camarões e lagostas;5,6
• Impedir o crescimento bacteriano em alimentos e bebidas fermentados;
• Manter a estabilidade e potência de certos medicamentos.4
Sulfitos e bissulfitos podem ser considerados antioxidantes in vivo: sulfitos são oxidados a sulfatos, e bissulfitos, também na lista de conservantes, são oxidados a bissulfatos.7 Em outras palavras, seu modo de atuação na preservação dos alimentos é o dos antioxidantes. Os sulfitos podem estar implicados em outras ações, sendo uma delas a prevenção de reações enzimáticas indesejáveis em bebidas / alimentos.3,7-9 Neste ponto, é interessante discutir os dados de toxicidade para considerar que nem todos os antioxidantes são inócuos, mas os aditivos alimentares nas doses utilizadas na atualidade podem ser considerados seguros, embora as pesquisas prossigam.10
Em 1958 o Federal Food, Drug, and Cosmetic Act responsável na ocasião pela regulamentação dos preservativos e aditivos alimentares considerou os sulfitos como seguros, recebendo a sigla GRAS (Generally Recognized As Safe).
Em 1968 foi relatada dermatite de contato em um trabalhador farmacêutico de 40 anos com dermatite de mão associada à exposição ocupacional ao metabissulfito de potássio.11
Em 1973 foi descrita pela primeira vez uma possível correlação entre sulfitos e asma em uma criança que apresentava crises de asma após a ingestão de frutas secas. Kochen formulou a hipótese de asma desencadeada pela liberação de dióxido de enxofre (SO2) quando da abertura da embalagem, que estava hermeticamente fechada.12 Em 1976 Prenner e Stevens13 descreveram o primeiro caso de anafilaxia devido à ingestão de bissulfito sódico.
Em 1982 a FDA iniciou uma reavaliação do status GRAS dos sulfitos após a notificação de numerosas manifestações de hipersensibilidade relacionadas a estes compostos. Em 1985 a FASEB (Federation of American Societies for Experimental Biology) examinou a ligação entre sulfitos e a dispneia, a urticária e o choque anafilático, concluindo que os sulfitos eram seguros para a maioria da população, sendo, entretanto, de imprevisível gravidade para asmáticos e hipersensíveis a estes preservativos. Em julho de 1986 a FDA proibiu o uso de conservantes à base de sulfitos em frutas e vegetais frescos após a morte de 13 pacientes com asma. Esta decisão era aguardada após cerca de 500 casos relatados à FDA, sendo que destes, 40% eram reações graves e ligadas a frutas e vegetais frescos enquanto que as 60% restantes a batatas, frutas secas, camarão e vinho.14
 Considerando a necessidade de constante aperfeiçoamento das ações de controle sanitário na área de alimentos, visando proteção à saúde da população, tornou-se indispensável o estabelecimento de regulamentos técnicos sobre aditivos em alimentos com vistas a minimizar os riscos à saúde humana. Foram estabelecidas inicialmente pela FDA, pela Comunidade Econômica Européia (CEE),10 no Brasil pela atual ANVISA15 e pelo Mercosul, certas normas sobre os sulfitos que são periodicamente atualizadas: Considerando a necessidade de constante aperfeiçoamento das ações de controle sanitário na área de alimentos, visando proteção à saúde da população, tornou-se indispensável o estabelecimento de regulamentos técnicos sobre aditivos em alimentos com vistas a minimizar os riscos à saúde humana. Foram estabelecidas inicialmente pela FDA, pela Comunidade Econômica Européia (CEE),10 no Brasil pela atual ANVISA15 e pelo Mercosul, certas normas sobre os sulfitos que são periodicamente atualizadas:
1 – Proibiu-se o uso de sulfitos para a manutenção da cor e consistência de frutas e vegetais crus, e em alimentos reconhecidos como fonte de vitamina B1, pois os sulfitos inativam a tiamina;
2 – Obrigaram os fabricantes de alimentos e bebidas a incluir nos rótulos de seus produtos a presença de sulfitos quando de concentrações iguais ou superiores a 10 ppm. Infelizmente concentrações menores que 10 ppm estão isentas desta obrigação, embora sejam capazes de desencadear crises de asma (Figura 1);
3 – Os preservativos que contêm sulfitos são proibidos também nas carnes, pois são capazes de restaurar e manter a cor vermelha, dando o falso aspecto de “carne fresca”. Sua utilização na carne vermelha é também contraindicada por ser uma fonte de tiamina. No Reino Unido são permitidos em linguiças e hambúrgueres, respeitando-se um limite de 450 ppm. No Canadá os sulfitos são permitidos em aves domésticas.
Tabela 1 – Sinônimos de Sulfitos
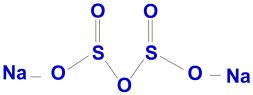
 Existem oito nomes pelos quais os sulfitos são encontrados como conservantes (Tabela 1): dióxido de enxofre (SO2), sulfito sódico (Na2SO3), bissulfito sódico (NaHSO3), bissulfito de potássio (KHSO3), metabissulfito de sódio (Na2S2O5), metabissulfito de potássio (K2S2O5), bissulfito de cálcio e sulfito ácido de cálcio. Os sulfitos, bissulfitos e metabissulfitos são formas químicas secas do gás dióxido de enxofre. Existem oito nomes pelos quais os sulfitos são encontrados como conservantes (Tabela 1): dióxido de enxofre (SO2), sulfito sódico (Na2SO3), bissulfito sódico (NaHSO3), bissulfito de potássio (KHSO3), metabissulfito de sódio (Na2S2O5), metabissulfito de potássio (K2S2O5), bissulfito de cálcio e sulfito ácido de cálcio. Os sulfitos, bissulfitos e metabissulfitos são formas químicas secas do gás dióxido de enxofre.
Patogênese
A reação adversa mais comum ao SO2 e a outros sulfitos no homem é a broncoconstrição/broncospasmo, particularmente em um subgrupo de Asmáticos Sensíveis aos Sulfitos (ASS), geralmente com asma severa. Cerca de 30% das reações são observadas em não asmáticos. Geralmente os pacientes com sintomas respiratórios ao poluente aéreo dióxido de enxofre são potencialmente mais suscetíveis aos sulfitos. Outras manifestações relatadas incluem rinite,16 anafilaxia,17 urticária,18 angioedema, rubor, hipotensão, náuseas, diarreia e parestesias.19
O mecanismo pelo qual os sulfitos provocam a broncoconstrição ainda é controverso. Em certos indivíduos com ASS, concentrações menores do que 1 ppm de SO2 são capazes de determinar importantes quedas do VEF1 (Volume Expiratório Forçado no primeiro segundo).20 Em indivíduos com asma, a hipersensibilidade induzida pelo SO2 parece ser mediada via receptores subepiteliais colinérgicos aferentes presentes na árvore brônquica.21,22
O metabissulfito de sódio é o principal composto usado na conservação de alimentos, gerando o dióxido de enxofre (SO2) e seus ânions. |
|
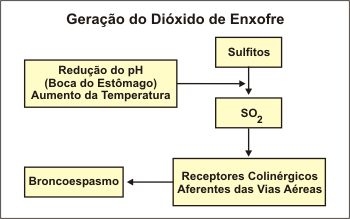
A broncoconstrição ocorre com maior frequência após a inalação/aspiração de SO2 do que após a sua ingestão, tanto em indivíduos com asma como em não asmáticos. O broncospasmo parece estar relacionado à inalação do SO2 liberado na boca ou no estômago. É possível que a inalação de SO2 possa ocorrer imediatamente após episódios de eructação. A quantidade de SO2 gerada pelos sulfitos em dissolução depende do pH e da temperatura. O ambiente quente e ácido da boca e do estômago favorece esta produção (Figura 2). Em condições ácidas (saliva e suco gástrico) e à temperatura corporal os sulfitos são prontamente convertidos em SO2, facilmente absorvido pelo trato respiratório, e reagem prontamente com a umidade das mucosas para formar ácido sulfuroso (H2SO3), que é um potente irritante. O mecanismo “seletivo” desencadeante pode estar relacionado ao padrão respiratório durante a mastigação, deglutição ou eructação, em conjunção com o grau de hiper-responsividade brônquica do paciente.23 As reações aos sulfitos são doses dependentes e ocorrem rapidamente em segundos até 30 minutos após a inalação, uso parenteral e ingestão.24 Não existe antídoto para o dióxido de enxofre. O tratamento consiste no suporte das funções respiratórias e cardiovasculares. No conteúdo gástrico, Allen e Delohery25 detectaram concentrações de 4–50 ppm em cinco indivíduos após teste de provocação oral com 25 ou 50 mg de metabissulfito.
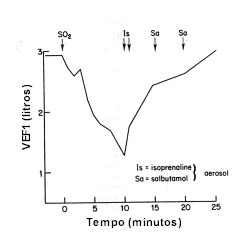
 Na boca, a utilização de colutório contendo mais de 100 mg de metabissulfito sódico (MBS) em 30 ml de solução de ácido cítrico, através de bochechos e gargarejos, resultou em queda de > 20% do VEF1 em 9 de 15 pacientes com asma. O mesmo procedimento efetuado nos que reagiram inicialmente foi repetido em uma segunda etapa, sem que se permitisse aos pacientes respirar (apneia) durante o procedimento de 'provocação'. Nenhum apresentou, desta feita, queda do VEF1.25 Na boca, a utilização de colutório contendo mais de 100 mg de metabissulfito sódico (MBS) em 30 ml de solução de ácido cítrico, através de bochechos e gargarejos, resultou em queda de > 20% do VEF1 em 9 de 15 pacientes com asma. O mesmo procedimento efetuado nos que reagiram inicialmente foi repetido em uma segunda etapa, sem que se permitisse aos pacientes respirar (apneia) durante o procedimento de 'provocação'. Nenhum apresentou, desta feita, queda do VEF1.25
Outra fonte ocorre quando da abertura de embalagens de alimentos que contêm sulfitos com desprendimento gasoso da substância. Werth26 relatou o caso de um paciente que apresentara broncospasmo após a inalação de gás depois da abertura de uma embalagem contendo damasco seco. Este mesmo indivíduo, entretanto, não apresentava nenhuma reação quando de teste oral de provocação com 50 mg de MBS.
Freedman27 avaliou 272 pacientes com asma, tendo relatado broncoconstrição em 30 (11%) após ingestão de suco de laranja contendo na solução o SO2. Testes de provocação foram efetuados em 14 destes, utilizando uma única dose de 25 mg de MBS (100 ppm em solução ácida). Em oito pacientes ocorreu queda de no mínimo 12% do VEF1 (média 37%) entre 2 e 25 minutos (média 5 min). Nesta publicação27 há também o relato de que em um copo com uma solução de 70 ppm de SO2 em água, o espaço de ar 3 cm acima da superfície líquida, contém 1 ppm de SO2 à temperatura ambiente. Tal concentração é capaz de determinar broncoconstrição em alguns pacientes com asma.20
Conforme relatado por Nair et al. (2003), a FDA analisou 767 notificações de reações adversas atribuídas à ingestão de alimentos tratados com sulfito. A maioria das reações ocorreu em asmáticos dependentes de corticoides, e muitos com insuficiência respiratória ou anafilaxia. A FDA analisou 22 mortes supostamente associadas à ingestão de sulfitos e constatou que em nove casos apresentavam alta probabilidade de associação com a ingestão de sulfito em pacientes com asma grave.28
As reações por sulfitos, embora mimetizem reações do tipo alérgico, não parecem mediadas por anticorpos.29-31 Entretanto, Stevenson e Simon32 identificaram anticorpos reagínicos contra o metabissulfito de potássio, através de testes cutâneos ou liberação de histamina leucocitária em 24 pacientes. O aquecimento do soro a 56ºC durante 30 minutos suprimia a atividade sensibilizante cutânea, o que apoiaria a tese de que o anticorpo implicado é IgE. Entretanto, o sulfito é uma molécula excessivamente pequena para atuar como um antígeno completo. São necessários mais estudos para demonstrar a hipótese de que o sulfito possa ser considerado como um hapteno, e que atue como tal. O conceito que predomina na atualidade é aquele causado pela irritação do trato respiratório e o pH como determinantes da resposta asmática.
Os sulfitos podem estimular o sistema parassimpático e provocam broncoconstrição colinérgica dependente, sendo particularmente proeminente em indivíduos com baixa atividade da enzima sulfito oxidase (SO).10 O Painel de reavaliação de segurança dos aditivos de alimentos da European Food Safety Authority (EFSA) e Additives and Nutrient Sources (ANS) de 2014 concluiu que: a histamina e outros mediadores bioativos podem ser liberados através de mecanismos não mediados por IgE; a síntese aumentada de prostaglandinas também pode produzir broncoconstrição e além disso, em modelos experimentais, os sulfitos podem contribuir para a persistência dos sintomas de asma crônica e aumentar a sensibilização alérgica e a inflamação das vias aéreas.10
A hipersensibilidade aos sulfitos na asma pode ser mediada via reflexos colinérgicos e também causada por níveis elevados de mediadores neuropeptídicos. Bellofiore et al.33 descreveram um possível mecanismo para o desencadeamento do broncospasmo relacionado à inalação do MBS, acreditando-se decorrer de um reflexo colinérgico e liberação de taquicininas por terminações nervosas sensitivas. As taquicininas são potentes broncoconstritores que sofrem clivagem e inativação nas vias aéreas pela enzima endopeptidase neutra (NEP). Para investigar o papel das taquicininas nas vias aéreas em resposta ao MBS, testaram a ação do Thiorphan (1,25 mg), substância que inibe os efeitos da NEP. Os autores avaliaram nove indivíduos não atópicos e não asmáticos, através de testes de provocação por inalação com MBS, e demonstraram que a inibição da NEP em normais aumentava o broncospasmo induzido pelo MBS.33
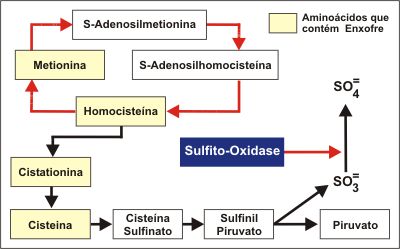 Durante o metabolismo de qualquer aminoácido que contenha enxofre ocorre a geração de sulfito. Na (Figura 3) é sumarizada a via metabólica endógena da produção intracelular do sulfito. O sulfito é oxidado in vivo para sulfato, através de rápida reação catalisada pela enzima sulfito oxidase (SO), localizada no espaço intermembranoso mitocondrial. Esta enzima tem sido bem caracterizada como um dímero, com peso molecular de 122.000 dáltons, e dependente de um cofator molibdênio. A concentração celular dos sulfitos é muito pequena para ser medida. Acredita-se que a sua produção endógena seja de aproximadamente 1.000 mg/dia, completamente oxidada pela enzima SO. Esta enzima, ubíqua, está largamente distribuída nos tecidos de mamíferos, apresentando maior atividade no fígado, coração e rins.34 O fígado é a sua principal fonte, porém, em estudos animais,35 sua atividade pôde ser detectada no epitélio das grandes vias aéreas, ainda que em menor intensidade do que no fígado.
Em casos de deficiência de SO, os tiossulfatos podem ser detectados em concentrações elevadas na urina. Em humanos, as concentrações médias de sulfito sérico total situam-se entre 4,63 e 5,16 µmol/L, sem correlação aparente com outros parâmetros bioquímicos ou a idade do indivíduo.36 Durante o metabolismo de qualquer aminoácido que contenha enxofre ocorre a geração de sulfito. Na (Figura 3) é sumarizada a via metabólica endógena da produção intracelular do sulfito. O sulfito é oxidado in vivo para sulfato, através de rápida reação catalisada pela enzima sulfito oxidase (SO), localizada no espaço intermembranoso mitocondrial. Esta enzima tem sido bem caracterizada como um dímero, com peso molecular de 122.000 dáltons, e dependente de um cofator molibdênio. A concentração celular dos sulfitos é muito pequena para ser medida. Acredita-se que a sua produção endógena seja de aproximadamente 1.000 mg/dia, completamente oxidada pela enzima SO. Esta enzima, ubíqua, está largamente distribuída nos tecidos de mamíferos, apresentando maior atividade no fígado, coração e rins.34 O fígado é a sua principal fonte, porém, em estudos animais,35 sua atividade pôde ser detectada no epitélio das grandes vias aéreas, ainda que em menor intensidade do que no fígado.
Em casos de deficiência de SO, os tiossulfatos podem ser detectados em concentrações elevadas na urina. Em humanos, as concentrações médias de sulfito sérico total situam-se entre 4,63 e 5,16 µmol/L, sem correlação aparente com outros parâmetros bioquímicos ou a idade do indivíduo.36
Supõe-se que alguns pacientes asmáticos com deficiência da enzima SO, embora capazes de oxidar sua produção endógena de sulfitos, não conseguem metabolizar sobrecargas de sulfito.37
Simon4 descreveu uma diminuição da atividade da enzima SO em culturas de fibroblastos obtidos através de biópsias de pele de seis pacientes sensíveis à substância. Não existem, entretanto, estudos com uma amostra maior de pacientes com ASS, ou com um grupo controle, que corrobore esta teoria. A deficiência da SO é uma doença autossômica recessiva muito rara, resultando em anormalidades neurológicas e inclusive morte.38 O gene humano já foi clonado e as mutações resultantes dos alelos anormais identificados.38,39 Não há relato de estudos genéticos específicos em indivíduos com asma por sulfitos. Acredita-se que se um indivíduo apresenta uma deficiência parcial da enzima SO, consequentemente menor capacidade para metabolizar os sulfitos ingeridos, associada a uma maior sensibilidade colinérgica respiratória, o desencadeamento de broncospasmo poderia ser hipoteticamente explicado pela soma destes dois fatores.
Os sulfitos são utilizados pela indústria farmacêutica devido as suas propriedades antioxidantes e pelo seu poder antibacteriano e antifúngico. Sua presença é encontrada em aminas pressoras (dopamina, metaraminol, noradrenalina), aminossalicilatos (mesalamina), analgésicos (meperidina), anestésicos locais (lidocaína, procaína), antiarrítmicos (procainamida, lidocaína), antibióticos (gentamicina, amicacina, tobramicina), broncodilatadores (catecolaminas, terbutalina injetável), colutórios (tintura de malva), contrastes, soluções tópicas (hidroquinona), soluções de nutrição parenteral e diálise etc.
Vally e Misso40 em uma revisão relataram que a exposição aos sulfitos decorre principalmente do consumo de alimentos e bebidas que contêm esses aditivos alimentares; no entanto, a exposição também pode ocorrer por meio do uso de produtos farmacêuticos, bem como em ambientes ocupacionais. A The Agency for Toxic Substances and Disease Registry (ATSDR) já em 1998 mencionava que os dados disponíveis indicavam que asmáticos sensíveis podem responder a concentrações de dióxido de enxofre tão baixas quanto 0,1 ppm no ar.41
Dentre os medicamentos deve ser ressaltada a sua utilização em anestésicos, sendo o bissulfito sódico ou o metabissulfito sódico encontrados em todos os tubetes de anestésico local de uso odontológico, que contêm vasoconstritores (adrenalina, levonordefrina). As concentrações variam de 0,15 a 2,0 mg. Huang e Fraser42 descreveram reações de hipersensibilidade aos sulfitos em concentrações de 0,6 a 0,9 mg, sendo estas quantidades facilmente alcançadas com injeções de 1–2 ml de anestésico local. Estes autores acreditam que estas quantidades de sulfitos nos anestésicos de uso odontológico constituem séria ameaça aos pacientes asmáticos. Por via subcutânea, entretanto, um estudo avaliou que doses de metabissulfito de até 10 vezes a quantidade geralmente encontrada em preparações de alguns anestésicos locais não causaram sintomas em um grupo de pacientes asmáticos sensíveis ao sulfito.43
Quanto à sensibilidade aos sulfitos alguns pontos devem ser destacados:44
∎ |
As reações aos alimentos com sulfitos dependem da sensibilidade individual, do nível de sulfitos no alimento e do tipo de alimento. |
∎ |
Os sulfitos são altamente reativos na presença de substâncias dos alimentos, como proteínas, amido e açúcares. Entretanto, a lavagem destes pode ajudar a reduzir, mas não eliminar completamente os sulfitos. |
∎ |
Os sulfitos não são desnaturados pela cocção, embora possam ser reduzidos em alguns alimentos. Assim, pessoas sensíveis devem evitar produtos processados e optar pelos in natura. |
∎ |
Não há evidência científica de que evitar o consumo de todas as fontes de sulfitos melhore os sintomas da asma, pois a sensibilidade pode não ser um fator significativo para a maioria das pessoas com asma. |
∎ |
A exposição de indivíduos que não são sensíveis aos sulfitos representa um risco muito pequeno a essas pessoas, salvo em concentrações muito altas, especialmente àquelas com asma ou sensibilidade a outros produtos químicos. |
∎ |
Os sulfatos não provocam os mesmos efeitos adversos dos sulfitos. Eles são sais inorgânicos que contêm o ânion sulfato (SO42-) e são encontrados em uma variedade de compostos, incluindo minerais, medicamentos, cosméticos, produtos de limpeza e não necessitam ser evitados por indivíduos sensíveis aos sulfitos. |
Diagnóstico
Testes de leitura imediata foram utilizados, tanto o teste intradérmico como o teste de puntura para diagnosticar a sensibilidade aos sulfitos.45 Um estudo de Gray et al.46 detectou sensibilidade ao sulfito em 12 casos dos 13 avaliados (92%). Apesar do reduzido tamanho da amostra examinada, o teste pode ter algum potencial como forma de diagnosticar a sensibilidade aos sulfitos.
É importante observar que um resultado negativo não descarta, nem confirma a sensibilidade ao sulfito. Atualmente não existem testes de alergia cutâneos ou séricos padronizados ou validados publicados para reações ao sulfito. A provocação oral controlada e gradual é a única maneira confiável de diagnosticar alergia ao sulfito. (ver abaixo).
Os sulfitos são administrados sob a forma de cápsulas de metabissulfito de potássio ou sob a forma de solução, em meio neutro ou ácido (ácido cítrico, suco de limão).47 Eles são administrados em doses crescentes, de 1 mg a 200 mg, com tomada a cada 30 minutos ou a cada hora. Certos autores recomendam iniciar o teste com cápsulas e se o resultado for negativo passar para a solução. Os efeitos são avaliados pela medida do VEF1 (Figura 4). O teste duplo-cego também pode ser útil (Tabelas 2 e 3).
Devido ao potencial de desencadear reações graves, o teste de provocação oral é efetuado em um ambiente hospitalar, onde há acesso imediato a cuidados médicos especializados.
Tabela 2 – Teste de Provocação com o Metabissulfito de Potássio através de Cápsulas ou Solução Oral Neutra (Adaptado da Referência 48)
Teste de Provocação com Metabissulfito de Potássio através de Cápsulas ou Solução Oral Neutra |
∎ |
Suspender o ß2-agonista cerca de oito horas antes das provas de função respiratória |
∎ |
Avaliar o VEF1 – o VEF1 deve ser ≥ 70% do teórico e ≥ 1500 ml em adultos. O teste está contraindicado para valores inferiores aos descritos. Não existem parâmetros definidos para crianças. |
Teste de Provocação – Estudo Cego |
∎ |
Administrar placebo sob a forma de cápsula (açúcar em pó) – medir o VEF1 |
∎ |
Administrar cápsulas de metabissulfito de potássio contendo 1, 5, 25, 50, 100 e 200 mg a intervalos de 30 minutos |
∎ |
Medir o VEF1 cerca de 30 minutos após cada dose ou se apresentar sintomas |
∎ |
Se não houver resposta, administrar 1, 10 e 25 mg de metabissulfito de potássio em solução açucarada a intervalos de 30 minutos. Medir o VEF1 após cada dose, ou se ocorrer sintomas. Um teste é considerado positivo se ocorrer queda do VEF1 ≥ 20% |
Teste de Provocação – Duplo-Cego |
∎ |
Efetuar o teste de provocação e placebo em dias separados por randomização |
∎ |
Dia "Placebo" – administrar apenas açúcar em cápsulas ou solução. Medir o VEF1 cerca de 30 minutos após cada dose ou se houver sintomas |
∎ |
Dia "Placebo" – administrar apenas açúcar em cápsulas ou solução. Medir o VEF1 cerca de 30 minutos após cada dose ou se houver sintomas |
∎ |
Dia "Provocação" – mesmo protocolo do Estudo Cego |
Tabela 3 – Teste de Provocação com o Metabissulfito de Potássio Utilizando Solução Oral Ácida
Teste de Provocação com Metabissulfito de Potássio Utilizando Solução Oral Ácida |
∎ |
Suspender o ß2-agonista cerca de oito horas antes das provas de função respiratória |
∎ |
Avaliar o VEF1 – o VEF1 deve ser ≥ 70% do teórico e ≥ 1500 ml em adultos. O teste está contraindicado para valores inferiores aos descritos. Não existem parâmetros definidos para crianças. |
Teste de Provocação com Metabissulfito de Potássio |
∎ |
Dissolver 0,1 mg de metabissulfito de potássio em 20 ml de limonada sem sulfito. Manter a solução por 10–15 segundos na boca engolindo-a em seguida |
∎ |
Medir o VEF1 dez minutos após a primeira dose. Administrar a intervalos de 10 minutos 0,5, 1,5,10, 15, 25, 50, 75, 100 mg/ml da solução. Medir o VEF1 dez minutos após cada dose progressiva. Um teste será considerado positivo se ocorrer queda do VEF1 ≥ 20% |
Em uma amostra de 203 pacientes adultos com asma, sendo 83 dependentes de corticoides, Bush et al.49 encontraram uma resposta positiva ao teste de provocação oral com sulfitos em aproximadamente 3,9% dos pacientes, sendo que os dependentes de corticoide se encontravam sob maior risco.
Uma característica primordial da asma desencadeada por SO2 é a rapidez do início dos sintomas, geralmente dentro de alguns segundos a dois minutos. Embora este curso de tempo possa ocorrer com alergias alimentares, um intervalo maior de 30 minutos entre a ingestão e o início dos sintomas excluiria o SO2 como a causa.24
Alguns cuidados a serem seguidos por pacientes asmáticos sensíveis aos sulfitos incluem:
➢ Verificar sempre na embalagem do produto a presença ou não da substância;
➢ Evitar comprar alimentos e bebidas que notoriamente contenham sulfitos como frutas secas, vegetais enlatados, vinhos etc. (Tabela 4);
➢ Se pretender comer batatas solicitar batata assada, evitando as fritas, chips e palha, ou qualquer prato que utilize batatas previamente descascadas;
Sempre que comer fora levar spray de ß2-agonista. Se já tiver no passado apresentado reação alérgica cutânea urticariforme ou simples prurido, ter sempre consigo anti-histamínico ou mesmo adrenalina (Epipen) ** para se autoadministrar. Estima-se que o consumo de alimentos preparados em casa leva à ingestão de apenas 2 a 3 mg / dia de sulfito. Os bebedores de cerveja e especialmente de vinho podem adicionar 5, 10 ou até mais mg / ~30 ml. Os alimentos preparados em restaurantes podem conter de 100 a 400 mg de sulfitos (não incluídos – cerveja e vinho).4
Os pacientes asmáticos sensíveis aos sulfitos necessitam, em sua grande maioria, da utilização de corticoides por longo prazo. A evolução da doença é muito semelhante à da asma por aspirina. Os sintomas são perenes, severos e agravados pela ingestão de sulfitos, havendo em muitos casos a associação com a rinossinusite. A cessação da ingestão de sulfitos evita acidentes mais graves mas não modifica o curso evolutivo da doença.
Tabela 4 — Alimentos que Contêm Sulfitos50
Alimentos que Contêm Sulfitos |
| Teor Alto – (> 100 ppm SO2) |
Baixo Teor – (< 100 ppm SO2) |
| Frutas secas
(como damascos, passas e ameixas) |
Vinagre de malte |
| Suco de limão (não congelado) |
Bacalhau salgado |
| Vinhos (especialmente vinhos Brancos) |
Batatas enlatadas |
| Melaço |
Cervejas |
| Sucos de Uva |
Mistura de sopa seca |
Teor Moderado – ( 50 - 99,9 ppm SO2) |
Refrigerantes |
| Batatas secas |
Chá instantâneo |
| Vinagre de Vinho |
Massa de pizza (congelada) |
| Molhos para saladas embalados |
Massa de torta |
| Coberturas de frutas |
Açúcar |
| Cerejas de marasquino |
Gelatina |
Teor Leve a Moderado – (10 e 49,9 ppm SO2) |
Coco |
| Camarão fresco |
Salada de frutas frescas |
| Pimenta em conserva |
Biscoitos |
| Picles/condimentos |
Uvas |
| Salsichas e embutidos processados |
Xarope de milho rico em frutose |
| Vários queijos |
Geleias caseiras |
| Canjica |
Salgadinhos e petiscos embalados |
| Batatas Congeladas
(pré-cortadas) |
|
| Doces e geleias em conserva |
|
| Misto de pão de milho/muffin |
|
| Cogumelos frescos |
|
| Vegetais desidratados |
|
** Adrenalina Epipen® – deve ser salientado >> a presença de um sulfito neste produto não deve impedir a administração do fármaco para o tratamento de situações alérgicas graves ou outras situações de emergência, mesmo que o paciente seja sensível ao sulfito.
|
|
Referências
01.Papazian R. Sulfites: safe for most, dangerous for some. FDA Consumer Magazine 1996; 30:10.
02.Vally H, Misso NL. Adverse reactions to the sulphite additives. Gastroenterol Hepatol Bed Bench 2012; 5:16-23.
03.Franco R, Navarro G, Martínez-Pinilla E. Antioxidants versus Food Antioxidant Additives and Food Preservatives. Antioxidants (Basel). 2019;8(11):542.
04.Simon RA. Sulfite sensitivity. Ann Allergy 1986; 56:2818.
05.Bailey ME, Fieger EA, Novak AF. Phenol oxidase in shrimp and crab. J Food Sci 1960; 25:565-572.
06.Bailey ME, Fieger EA, Novak AF.
Physico-chemical properties of the enzymes involved in shrimp melanogenesis. J Food Sci 1960; 25:557-564.
07.Gould GW, Russell NJ.– Sulfite. In: Russell NJ, Gould GW. Food Preservatives. Boston: Springer; 2003:85-101.
08.Wedzicha BL. – Chemistry of Sulphur Dioxide in Foods. Essex: Elsevier Applied Science Publishers Ltd.; 1984.
09.Ough CS. Sulfur Dioxide and Sulfites. Antimicrob Foods 1993; 137-190.
10.Scientific Opinion on the re-evaluation of sulfur dioxide (E 220), sodium sulfite (E 221), sodium bisulfite (E 222), sodium metabisulfite (E 223), potassium metabisulfite (E 224), calcium sulfite (E 226), calcium bisulfite (E 227) and potassium bisulfite (E 228) as food additives1 EFSA Panel on Food additives and Nutrient Sources added to Food (ANS). EFSA Journal 2016;14(4):4438. https://doi.org/10.2903/j.efsa.2016.4438.
11.Nater JP. Allergic contact dermatitis caused by potassium metabisulfite. Dermatologica 1968; 136:477-8.
12.Kochen J. Sulfur dioxide. A respiratory tract irritant, even if ingested. Pediatrics 1973; 52:145-46.
13.Prenner BM, Stevens JJ. Anaphylaxis after ingestion of sodium bisulfite. Ann Allergy 1976; 37:180-2.
14.US. Issues Ban on Sulfites Use in Certain Foods. Irvin Molotsky. Special to The New York Times. July 9, 1986, Section A, Page 1.
15.Brasil. Ministério da Saúde. Agência Nacional de Vigilância Sanitária. Legislação. Portarias. nº. 778 de 1º de março de 2023. Dispõe sobre os princípios gerais, as funções tecnológicas e as condições de uso de aditivos alimentares e coadjuvantes de tecnologia em alimentos. Disponível em: https://antigo.anvisa.gov.br/documents/10181/6561857/RDC_778_2023_.pdf/a89bb838-62e4-4471-a28f-ff28e3e97241 Acesso em: 19/03/2024.
16.Asero R. Multiple intolerance to food additives. J Allergy Clin Immunol 2002; 10:531-2.
17.Maintz L, Novak N. Histamine and histamine intolerance. Am J Clin Nutr 2007; 85:1185-96.
18.Ban GY, Kim MA, Yoo HS, Ye YM, Park HS. Letter to the editor. Two major phenotypes of sulfite hypersensitivity: asthma and urticaria. Yonsei Med J. 2014; 55:542-4.
19.NIH1984. Adverse reactions to food. American Academy of Allergy and Immunology, Committee on Adverse Reactions to Food, National Institute od Allergy and Infectious Diseases, National Institutes of Health. NIH Publication Np. 84-2442. 220 pp. Avaible from: US Governement Printing Office, Washington, DC, USA.
20.Boushey HA. Bronchial hyperreactivity to sulphur dioxide: physiologic and political implications. J Allergy Clin Immunol 1982; 69:335-8.
21.Nadel JA. Aerosol effects on smooth muscle and airway visualisation technique. Arch Inter Med 1973; 131:83-7.
22.Nadel JA, Salem H, Tamplin B, Tokiva Y. Mechanism of bronchoconstriction during inhalation of sulphur dioxide. J Appl Physiol 1965; 20:164-7.
23.Cockcroft D. - Provocation Tests. In: O'Byrne PM, Thomson NC. Manual of Asthma Management. London: W.B.Saunders; 2001:91-97.
24.Freedman BJ. Sulphur dioxide in foods and beverages: Its use as a preservative and its effect on asthma. Br J Dis Chest 1980; 74:128-134.
25.Allen D, Delohery J. Metabisulfite-induced asthma. J Allergy Clin Immunol 1985; 75:145 (Abstract).
26.Werth GR. Inhaled metabisulfite sensitivity. J Allergy Clin Immunol 1982; 70:143.
27.Freedman BJ. Asthma induced by sulphur dioxide, benzoate and tartrazine contained in orange drinks. Clin Allergy 1977; 7:407-15.
28.Nair B, Elmore AR and Cosmetic IREP, 2003. Final report on the safety assessment of sodium sulphite, potassium sulphite, ammonium sulphite, sodium bisulphite, ammonium bisulphite, sodium metabisulphite and potassium metabisulphite. International Journal of Toxicology 22 Suppl 2, 63–88.
29.Yang WH, Purchase ECR, Rivington RN. Positive skin tests and Prausnitz-Kustner reactions in metabisulfite-sensitive subjects. J Allergy Clin Immunol 1986; 78:443-9.
30.Prenner M, Stevens JJ. Anaphylaxis after ingestion of sodium bisulfite. Ann Allergy 1976; 37:180-2.
31.Boxer MB, Bush RK, Harris KE, Patterson R, Pruzansky JJ, Yang WH.
The laboratory evaluation of IgE antibody to metabisulfites in patients skin test positive to metabisulfites. J Allergy Immunol 1988; 82:622-6.
32.Stevenson DD, Simon RA. Sensitivity to ingested metabisulfites in asthmatics subjects. J Allergy Clin Immunol 1981; 68:26-32.
33.Bellofiore S, Caltagione F, Pennisi A, Ciancio N, Mistretta A, Di Maria GU. Neutral endopeptidase inhibitor thiorphan increases airway narrowing to inhaled sodium metabisulfite in normal subjects. Am J Respir Crit Care Med 1994; 150:853-6.
34.Gunnison AF. Sulfite toxicity: A critical review of in vitro and in vivo data. Food Cosmet Toxicol 1981; 19:667-82.
35.Maier KL, Wippermann U, Leuschel L, Josten M, Pflugmacher S, Schröder P, Sandermann H Jr, Takenaka S, Ziesenis A, Heyder J. Xenobiotic metabolizing enzymes in the canine respiratory tract. Inhal Toxicol 1999; 11:19-35.
36.Pinzaru IA, Dehelean CA. – Sodium Sulfite. In:Philip Wexler. Encyclopedia of Toxicology. Academic Press; Volume 8, 2024: 625-629.
37.Fisher AA. Reactions to injectable local anesthetics. Part IV: Reactions to sulfites in local anesthetics. Cutis 1989; 44:283-4.
38.Kisker C, Schindelin H, Pacheco A, Wehbi WA, Garrett RM, Rajagopalan KV, Enemark JH, Rees DC.
Molecular basis of sulfite oxidase deficiency from the structure of sulfite oxidase. Cell 1997; 91:973-83.
39.Garrett RM, Bellissimo DB, Rajagopalan KV. Molecular cloning of human liver sulfite oxidase. Biochim Biophys Acta 1995; 1262:147-9.
40.Vally H and Misso NLA, 2012. Adverse reactions to the sulphite additives. Gastroenterol Hepatol Bed Bench 2012; 5:16-23.
41.ATSDR (Agency for Toxic Substances and Disease Registry), 1998. Toxicological Profile for Sulfur Dioxide, December 1998. Department of Health and Human Services. Agency for Toxic Substances and Disease Registry. Available online: http://www.atsdr.cdc.gov/toxprofiles/ tp.asp?id=253&tid=46.
42.Huang AS, Fraser WN. Are sulfite additives really safe? {Letter}. N Engl J Med 1984; 311:542.
43.Goldfarb G, Simon RA. Provocation of sulfite sensitive asthma (abst). J Allergy Clin Immunol (suppl) 1984; 73:135.
44.Popolim WD. Análise de Sulfitos em Sucos de Frutas e Estimativa de seu Consumo por Escolares. 2009. 155 pg. Tese de Doutorado – Programa de Pós-Graduação Interunidades em Nutrição Humana Aplicada – PRONUT. Universidade de São Paulo. São Paulo.
45.Bold J. Considerations for the diagnosis and management of sulphite sensitivity. Gastroenterol Hepatol Bed Bench 2012 Winter; 5:3-6.
46.Gay G, Sabbah A, Drouet M. Valeur diagnostique de l'épidermotest aux sulfites [Diagnostic value of the sulfite skin test]. Allerg Immunol 1994; 26:139-40.
47.Bush RK, Taylor SL, Busse WA. A critical evaluation of clinical trials in reactions to sulphites. J Allergy Clin Immunol 1986; 78:191-202.
48.Bush RK. Sulfite and aspirin sensitivity: who is most susceptible? J Respir Dis 1987; 8:23-32.
49.Bush RK, Taylor SL, Holden K, Nordlee JA, Busse WW. The prevalence of sensitivity to sulfiting agents in asthmatics. Am J Med 1986; 81:816-20.
50.Lester MR. Sulfite sensitivity: significance in human health. J Am Coll Nutr 1995; 14:229-32.
| |
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|