|
Asma
FATOR DE NECROSE TUMORAL ALFA
As alterações brônquicas no fenótipo da asma severa refratária diferem daquelas encontradas na asma leve a moderada, encontrando-se uma resposta de configuração inflamatória mais heterogênea,1 com a participação só de neutrófilos2 ou em associação com eosinófilos, com intensa participação do pulmão distal3 e remodelamento brônquico.4 Inicialmente acreditava-se que este processo ocorresse em decorrência da resposta aos corticoides inalados, pois, contrariamente ao efeito pró-apoptose nos eosinófilos, os corticoides estimulam a sobrevida dos neutrófilos.5 Na asma severa os neutrófilos parecem estar em estado de ativação,6 havendo correlação entre o seu número e o grau de dano tecidual das vias aéreas,7,8 configurando uma resposta terapêutica reduzida aos corticoides.9
Estas mudanças são explicadas pela mudança na conformação inflamatória, na direção TH2 para TH1, com aumento da expressão do fator de necrose tumoral alfa (TNF)-a e do interferon-g (IFN)-g.10
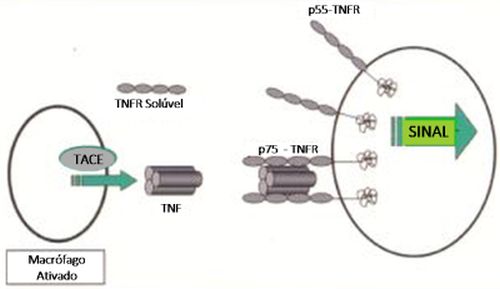 A atividade biológica do TNF-a é mediada pela proteína precursora transmembrana 26-kD (membrane-bound TNF-a) bem como pelo produto de clivagem 17-kD, o TNF-a livre. O TNF-a é uma citocina inflamatória pleiotrófica expressa em quantidades aumentadas pelos monócitos ativados, macrófagos, linfócitos e mastócitos,11 como um homotrímero composto por três moléculas TNF 17-kD. O TNF-a é liberado pela membrana celular através da atividade da enzima conversora do TNF (TACE). A atividade TNF-a é mediada através da ligação aos receptores de membrana (p55 e p75 TNFR) encontrados em diferentes células, como leucócitos, células dendríticas, células endoteliais vasculares e células mesenquimais. Uma molécula de TNF-a deve se combinar a dois ou mais TNFRs para iniciar a transdução do sinal intracelular. A atividade TNF é naturalmente regulada pela produção de TNFRs solúveis os quais tornam o TNF-a biologicamente indisponível, impedindo a sua ligação aos receptores de membrana celular.12 (Figura 1) A atividade biológica do TNF-a é mediada pela proteína precursora transmembrana 26-kD (membrane-bound TNF-a) bem como pelo produto de clivagem 17-kD, o TNF-a livre. O TNF-a é uma citocina inflamatória pleiotrófica expressa em quantidades aumentadas pelos monócitos ativados, macrófagos, linfócitos e mastócitos,11 como um homotrímero composto por três moléculas TNF 17-kD. O TNF-a é liberado pela membrana celular através da atividade da enzima conversora do TNF (TACE). A atividade TNF-a é mediada através da ligação aos receptores de membrana (p55 e p75 TNFR) encontrados em diferentes células, como leucócitos, células dendríticas, células endoteliais vasculares e células mesenquimais. Uma molécula de TNF-a deve se combinar a dois ou mais TNFRs para iniciar a transdução do sinal intracelular. A atividade TNF é naturalmente regulada pela produção de TNFRs solúveis os quais tornam o TNF-a biologicamente indisponível, impedindo a sua ligação aos receptores de membrana celular.12 (Figura 1)
O TNF-a foi originalmente descrito como um fator indutor da necrose de alguns tumores. Na atualidade é reconhecido como uma importante citocina pró-inflamatória, com largo espectro de ação que inclui recrutamento de neutrófilos através da indução de moléculas de adesão na parede vascular endotelial e indução da síntese de citocinas e quimocinas.
Níveis elevados de TNF-a foram detectados no escarro,13,14 no lavado broncoalveolar15 e em biópsias de pacientes com asma.16 A inalação de TNF-a determina hiper-responsividade brônquica e aumento da neutrofilia do escarro em voluntários.17 A importância do TNF-a como uma citocina multifuncional na asma severa refratária tem sido reforçada pela constatação de aumento de mais de 30 vezes na sua expressão gênica nas vias aéreas. Ocorre aumento na expressão do precursor de membrana TNF-a de células mononucleares, na TACE e de seus receptores p75 e p55,18 assim como no incremento da secreção de TNF-a solúvel mesmo na presença de altas doses de corticoides. De especial relevância deve ser salientado que o TNF-a tem o efeito potencial de estimular fibroblastos, miofibroblastos e células musculares lisas induzindo e liberando proteases.19,20 Através destas variadas atuações o TNF-a contribui de forma substancial na patogênese da inflamação crônica das vias aéreas, incluindo o remodelamento brônquico. O TNF-a tem potente efeito direto no músculo liso determinando hiper-responsividade das vias aéreas. Os mecanismos responsáveis por esta mudança no fenótipo inflamatório não são conhecidos, embora o TNF-a tenha demonstrado aumentar os níveis da isoforma-b dos receptores de corticoides21 e apresente múltiplos efeitos na inflamação e na estrutura celular das vias aéreas.
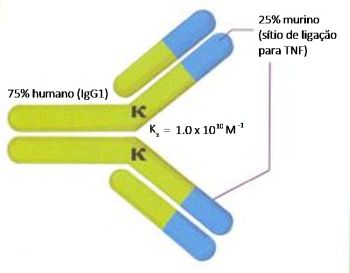 Existem vários estudos em andamento, sugerindo que o TNF-a se constitua em um importante mediador inflamatório na asma severa. Duas modalidades terapêuticas utilizam esta nova via, utilizando os TNFRs solúveis recombinantes e anticorpos monoclonais contra o TNF-a. Os TNFRs solúveis recombinantes mimetizam a atividade dos TNFRs naturais e quando de sua ligação com o TNF previnem a interação com o TNFR da membrana celular. A droga mais avaliada é o etanercept, já utilizado no tratamento da artrite reumatoide, e em fase de análise na asma brônquica, com resultados promissores.18 A segunda abordagem terapêutica utiliza o infliximab, um anticorpo monoclonal IgG1 quimérico constituído por 75% de proteína humana e 25% de proteína de murídeo.22 A porção de murídeo contém o sítio de ligação para o TNF-a, enquanto a porção humana é responsável pela função efetora (Figura 2).12
O infliximab liga-se especificamente ao TNF-a e assim neutraliza tanto o TNF-a transmembrana como o TNF-a solúvel. Além disso, estudos in vitro mostraram que o infliximab provoca lise de células produtoras de TNF através de fixação do complemento ou citotoxicidade dependente de anticorpos (ADCC: Antibody-Dependent Cytotoxity).23 Existem vários estudos em andamento, sugerindo que o TNF-a se constitua em um importante mediador inflamatório na asma severa. Duas modalidades terapêuticas utilizam esta nova via, utilizando os TNFRs solúveis recombinantes e anticorpos monoclonais contra o TNF-a. Os TNFRs solúveis recombinantes mimetizam a atividade dos TNFRs naturais e quando de sua ligação com o TNF previnem a interação com o TNFR da membrana celular. A droga mais avaliada é o etanercept, já utilizado no tratamento da artrite reumatoide, e em fase de análise na asma brônquica, com resultados promissores.18 A segunda abordagem terapêutica utiliza o infliximab, um anticorpo monoclonal IgG1 quimérico constituído por 75% de proteína humana e 25% de proteína de murídeo.22 A porção de murídeo contém o sítio de ligação para o TNF-a, enquanto a porção humana é responsável pela função efetora (Figura 2).12
O infliximab liga-se especificamente ao TNF-a e assim neutraliza tanto o TNF-a transmembrana como o TNF-a solúvel. Além disso, estudos in vitro mostraram que o infliximab provoca lise de células produtoras de TNF através de fixação do complemento ou citotoxicidade dependente de anticorpos (ADCC: Antibody-Dependent Cytotoxity).23
A TACE (TNF-a-converting enzyme) é a enzima metaloprotease importante para a liberação do TNF-a pela superfície celular. Pequenas moléculas que bloqueiam a TACE estão sendo desenvolvidas como inibidoras do TNF-a porém, sem aplicação clínica até o momento devido a efeitos residuais.
Referências
01.Wenzel SE, Schwartz LB, Langmack EL, et al. Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics. Am J Respir Crit Care Med 1999; 160:1001-8.
02.The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma: European Network for Understanding Mechanisms of Severe Asthma. Eur Respir J 2003; 22:470-7.
03.Berry M, Hargadon B, Morgan A, Shelley M, Richter J, Shaw D, Green RH, Brightling C, Wardlaw AJ, Pavord ID.
Alveolar nitric oxide in adults with asthma: evidence of distal lung inflammation in refractory asthma. Eur Respir J 2005; 25:986-91.
04.Busse W, Elias J, Sheppard D, Banks-Schlegel S. Airway remodeling and repair. Am J Respir Crit Care Med 1999; 160:1035-42.
05.Nguyen LT, Lim S, Oates T, Chung KF. Increase in airway neutrophils after oral but not inhaled corticosteroid therapy. Respir Med 2005; 99:200-7.
06.Gibson PJ, Simpson JL, Saltos N. Heterogeneity of airway inflammation in persistent asthma: evidence of neutrophilic inflammation and increased sputum IL-8. Chest 2001; 119:1329-36.
07.Hamilton LM, Torres-Lozano C, Puddicombe SM, Richter A, Kimber I, Dearman RJ, Vrugt B, Aalbers R, Holgate ST, Djukanovic R, Wilson SJ, Davies DE. Role of the epidermal growth factor receptor in sustaining neutrophil inflammation in severe asthma. Clin Exp Allergy 2003; 33:233-40.
08.Wenzel SE, Schwartz LB, Langmack EL, Halliday JL, Trudeau JB, Gibbs RL, Chu HW.
Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics. Am J Respir Crit Care Med 1999; 160:1001-8.
09.Green RH, Brightling CE, Woltmann G, Parker D, Wardlaw AJ, Pavord ID. Analysis of induced sputum in adults with asthma: identification of a subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids. Thorax 2002; 57:875-9.
10.Truyen E, Coteur L, Dilissen E, Overbergh L, Dupont LJ, Ceuppens JL, Bullens DM.
Evaluation of airway inflammation by quantitative Th1/Th2 cytokine mRNA measurement in sputum of asthma patients. Thorax 2006; 61:202-8.
11.Bradding P, Roberts JA, Britten KM, Montefort S, Djukanovic R, Mueller R, Heusser CH, Howarth PH, Holgate ST.
Interleukin-4, -5, and -6 and tumor necrosis factor-alpha in normal and asthmatic airways: evidence for the human mast cell as a source of these cytokines. Am J Respir Cell Mol Biol 1994; 10:471-80.
12.McDonnell ND, Abbott NN, Mohler KM, Hansel TT, Kips JC. – TNF Antagonism. In: Hansell TT, Barnes PJ. New Drugs for Asrhma Allergy and COPD. Prog Respir Res. Basel: Karger: 2001:247-250.
13.Keatings VM, Collins PD, Scott DM, Barnes PJ. Differences in interleukin-8 and tumor necrosis factor-alpha in induced sputum from patients with chronic obstructive pulmonary disease or asthma. Am J Respir Crit Care Med 1996; 153:530-4.
14.Keatings VM, Jatakanon A, Worsdell YM, Barnes PJ. Effects of inhaled and oral glucocorticoids on inflammatory indices in asthma and COPD. Am J Crit Care Med 1997; 155:542-8.
15.Broide DH, Lotz M, Cuomo AJ, Coburn DA, Federman EC, Wasserman SI. Cytokines in symptomatic asthma airways. J Allergy Clin Immunol 1992; 89:959-67.
16.Ackerman V, Marini M, Vittori E, Bellini A, Vassali G, Mattoli S. Detection of cytokines and their cell sources in bronchial biopsy specimens from asthmatic patients. Relationship to atopic status, symptoms, and level of airway hyperresponsiveness. Chest 1994; 105:687-96.
17.Thomas PS, Yates DH, Barnes PJ. Tumor necrosis factor-alpha increases airway responsiveness and sputum neutrophilia in normal human subjects. Am J Respir Crit Care Med 1995; 152:76-80.
18.Erzurum SP. Inhibition of tumor necrosis factor α for refractory asthma. N Engl J Med 2006; 354:754-8.
19.Schwingshackl A, Duszyk M, Brown N, Moqbel R. Human eosinophils release matrix metalloproteinase-9 on stimulation with TNF-alpha. J Allergy Clin Immunol 1999; 104:983-9.
20.Amrani Y, Panettieri RA Jr, Frossard N, Bronner C. Activation of the TNF alpha-p55 receptor induces myocyte proliferation and modulates agonist-evoked calcium transients in cultured human tracheal smooth muscle cells. Am J Respir Cell Mol Biol 1996; 15:55-63.
21.Webster JC, Oakley RH, Jewell CM, Cidlowski JA. Proinflammatory cytokines regulate human glucocorticoids receptor gene expression and lead to the accumulation of the dominant negative beta isoform: mechanism for the generation of glucocorticoids
resistance. Proc Natl Acad Sci USA2001; 98:6865-70.
22.Harriman G, Harper LK, Schaible TE. Summary of clinical trials in rheumatoid arthrits using infliximab, an anti-TNF-a traetment. Ann Rheum Dis 1998; 58(suppl 1):161-164.
23.Scallon BJ, Moore MA, Trinh H, Knight DM, Ghrayeb J. Chimeric anti-TNF alpha antibody cA2 binds recombinant transmembrane TNF-alpha and activates immune effector functions. Cytokine 1995; 7:251-259.
24.Knight DM, Trinh H, LE J, et al. Construction and initial characterization of a mouse-human chimeric anti-TNF antibody. Mol Immunol 1993; 30:1443-1453.
|