Informações Médicas |
Copyright © 1997 - 2025 Dr. Pierre d'Almeida Telles Filho  |
Asma
Fisiopatologia da Asma
Teste de Broncoprovocação Utilizando Cloreto de Metacolina
A hiper-responsividade das vias respiratórias é a resposta broncoconstritora aumentada a estímulos que produziriam pouco ou nenhum efeito em indivíduos saudáveis. O teste de broncoprovocação utilizando o cloreto de metacolina é um dos métodos de teste de avaliação da hiper-responsividade brônquica.
O teste de broncoprovocação (TBP) com metacolina é mais útil para se excluir um diagnóstico de asma do que para estabelecer um,1 isto porque seu valor preditivo negativo, quando os sintomas respiratórios estão presentes, é maior do que seu valor preditivo positivo. O teste é indicado sobretudo para indivíduos com possíveis sintomas de asma e espirometria normal ou não diagnóstica (i.e. sem resposta ao broncodilatador).
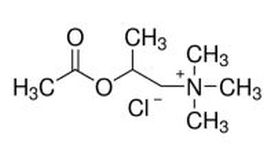
➢ Fórmula — cloreto de metacolina (o elemento ativo) é o cloreto de 2-(acetiloxi) - N,N,N-trimetilpropan-1-amínio. Ele está disponível como um pó cristalino seco com uma fórmula empírica de C8 H18ClNO2 e tem peso molecular calculado de 195,69 (Figura 1). O cloreto de metacolina está disponível em frascos de vidro âmbar de 20 ml contendo 100 mg da substância em pó – nome comercial – Provocholine®.
Fígura 1 – Fórmula da Metacolina
O cloreto de metacolina é o β-metil homólogo da acetilcolina (ACh) pesquisado por Hunt e Taveau em 19112, diferindo desta última principalmente por seu tempo de ação mais longo e seletividade, por isso, útil em testes de broncoprovocação para permitir tempo para avaliação da responsividade.3 O músculo liso brônquico contém inervação colinérgica significativa. A broncoconstrição ocorre quando o nervo vago é estimulado e a ACh é liberada das terminações nervosas. A constrição muscular é essencialmente confinada ao local de liberação (áreas localizadas de despolarização) porque a ACh é rapidamente inativada pela enzima acetilcolinesterase. A metacolina interage mimetizando as ações da ACh e atua diretamente com os receptores muscarínicos no músculo liso das vias aéreas. Comparado com a ACh, o cloreto de metacolina é mais lentamente hidrolisado pela acetilcolinesterase e totalmente resistente à inativação pela colinesterase não específica ou pseudocolinesterase. Seus efeitos podem ser parcialmente bloqueados por agentes anticolinérgicos, como o brometo de ipratrópio.
A metacolina é preferível a outros agentes de broncoprovocação farmacológica, como a histamina, devido aos seus efeitos colaterais sistêmicos limitados.3,4 Existem diferentes protocolos de testes de administração do TBP da metacolina, com administração de diferentes doses. Cada protocolo apresenta vantagens e desvantagens, sendo que não ocorria um consenso ou uma recomendação única.
Em 1999 a diretriz da American Thoracic Society (ATS)5 recomendou o método de respiração corrente (normal; 'tranquila'; ao nível do volume corrente) de 2 minutos e o método do dosímetro (de cinco respirações), cada um com um sistema de administração específico.5 Embora os cálculos estimassem que a dose de metacolina administrada em cada etapa seria duas vezes maior com o método de respiração corrente, era esperado que respirações profundas com retenção de 5 segundos na capacidade pulmonar total (CPT) no método do dosímetro, permitiriam melhor distribuição e retenção do aerossol e os primeiros estudos sugeriram que os dois métodos de liberação dariam resultados análogos.5
Estudos de Cockcroft et al. e Prieto et al. evidenciaram pequenas diferenças entre os métodos quando a concentração provocativa (PC20) foi baixa em indivíduos asmáticos mais graves, mas os métodos não são tão comparáveis em indivíduos com menos hiper-responsividade brônquica (HRB).6,7 Um indivíduo considerado com HRB leve pelo método de respiração corrente de 2 minutos pode ser considerado normal pelo método do dosímetro. O método de respiração contínua, que expõe o indivíduo a duas vezes mais aerossol em cada concentração, produziu aproximadamente o dobro da resposta. As manobras de CPT com apneia durante o método do dosímetro podem inibir a resposta em alguns pacientes com asma.6 Essa taxa de falsos negativos foi de 25% de todos os testes e 50% daqueles com HRB leve / moderada em uma série.8 Isso revela que o método de dosímetro padronizado apresenta uma perda inaceitável de sensibilidade diagnóstica.
A diferença pode ser atribuída ao efeito broncodilatador ou broncoprotetor de uma manobra inspiratória máxima com apneia na CPT. Este efeito é observado em indivíduos normais e indivíduos com asma leve, mas é perdido quando de doença mais grave.9,10 As respirações profundas devem ser evitadas tanto quanto possível pois alteram o tônus broncomotor. Todavia, nem todas, pois o teste requer inspirações profundas para medidas do VEF1.
O desempenho do teste com níveis baixos de HRB é particularmente importante porque uma das vantagens principais do TBP da metacolina é seu valor preditivo negativo para se descartar o diagnóstico de asma. Por essas razões, os métodos que exigem inalações máximas até CPT durante a administração do aerossol não são mais recomendados.
As normas mais recentes elaboradas por uma força-tarefa da European Respiratory Society (ERS) e ATS privilegiam os dispositivos por inalação adequados,11 que diferem dos prescritos nas diretrizes anteriores,12 apenas porque os antigos não são mais fabricados. Agora é possível se calcular a quantidade de metacolina liberada.11 Em vez de basear o resultado do teste em uma PC20 causando uma queda de 20% no VEF1, as novas recomendações baseiam o resultado na dose efetiva de metacolina administrada (PD
20 ) causando a queda no VEF1 ≥ 20%. O end-point PD20 permite resultados comparáveis de diferentes dispositivos ou protocolos.
➢ Inalação — Respirando ao nível do volume corrente, utilizando um nebulizador contínuo tipo English Wright, aplicando-se o método de dosagens em etapas subsequentes de duplicação ou quadruplicação, o VEF1 é medido a 30 e 90 segundos após a inalação do aerossol, durante o qual o paciente deve ser treinado adequadamente para garantir medições de qualidade, até que ocorra a queda do VEF1 ≥ 20%. Recomenda-se um tempo de respiração de pelo menos 1 minuto, não obstante um tempo de respiração de dois minutos possa melhorar a reprodutibilidade.11
A metacolina é administrada sequencialmente em concentrações crescentes variando de 0,0625 a 16 mg/ml (Tabela 1). A quadruplicação em si propicia menos etapas de concentração, técnica que foi utilizada por vários pesquisadores para economizar tempo,13,14 sem qualquer aumento manifesto no risco de broncoconstrição grave. Entretanto, se o TBP da metacolina for utilizado para determinar mudanças na responsividade das vias aéreas em pacientes com asma após tratamento, o uso de doses duplas será mais preciso em fornecer resultados para PD20.
Tabela 1 – Exemplo de Doses Utilizando o Nebulizador English Wright por 2 min
São mostradas as doses incrementais em concentrações específicas para incrementos de duplicação e quadruplicação
Para se submeter ao TBP da metacolina o paciente deve ser capaz de realizar uma espirometria confiável. O VEF1 então é medido em 30, depois 90 segundos após a inalação do aerossol, durante o qual o paciente deve ser adequadamente treinado para garantir medições de qualidade.
Deve ser instruído a suspender todos os medicamentos contra a asma e qualquer outro medicamento ou alimento que contenha cafeína (café, chá, "colas")15 e teobromina (chocolates), por horas ou mesmo dias antes de se submeter ao teste (Tabela 2). Outros fatores que podem alterar os resultados são: tabagismo ativo, sensibilizantes ocupacionais, infecções respiratórias, alérgenos específicos e exercício vigoroso. Informar que o teste tem um tempo de duração entre cinquenta minutos e uma hora. Solicitar ao paciente que urine antes do teste, pois incontinência de estresse pode ser desencadeada, especialmente em mulheres com mais idade. É obrigatório informar ao paciente, ou ao seu responsável legal, os potenciais riscos e efeitos colaterais relacionados à metacolina (tosse, broncospasmo, 'aperto' no peito, vertigens etc.), o que deverá ser formalizado por meio de Termo de Consentimento Informado. Enfermeiros ou técnicos que têm asma ou rinite alérgica não devem administrar o teste de metacolina.
Tabela 2 – Medicamentos que Devem Ser Suspensos Antes do Teste de Broncoprovocação16-19
MEDICAMENTO |
Quando Suspender |
| β-agonista de curta ação (p. ex. salbutamol) | 6 h |
| β-agonista de longa ação (p. ex. formoterol) | 36 h |
| β-agonista de ação ultralonga (p. ex. vilanterol) | 48 h |
| Agente antimuscarínico de ação curta (p. ex. ipratrópio) | 12 h |
| Agentes antimuscarínicos de ação prolongada (p. ex. tiotrópio) | ≥ 7 dias |
| Teofilina oral | 12–24 h |
| Anti-histamínicos | 3 dias |
| Corticoide inalado e oral | 7–21 dias |
| Antagonistas de resceptores de leucotrienos (p. ex. montelucaste) | 48 h |
| Cromonas (p. ex. cromoglicato) | 8 h |
Antes de o teste de broncoprovocação ser iniciado, deve-se efetuar um teste de função respiratória. Para um paciente se submeter ao teste de broncoprovocação, seu VEF1 deve ser ≥ 60% do teórico ou ≥ 1,5 l.12 Pacientes hipertensos mal controlados não devem expor-se a este tipo de exame. Outras contraindicações incluem aneurisma de aorta, e história de infarto do miocárdio ou AVC recentes (3 meses).20 Na eventualidade de cirurgia oftalmológica recente ou qualquer outra condição em que a pressão intracraniana elevada, em decorrência da expiração forçada seja prejudicial, é uma contraindicação. Existem contraindicações relativas no que tange aos pacientes em uso de medicação inibidora da colinesterase. O TBP não é recomendado na gravidez e em mães durante a lactação, não se sabendo ainda se a metacolina é excretada no leite materno.5
Se os medicamentos para asma forem descontinuados antes do TBP com metacolina, considere a possibilidade de rebote da hiper-responsividade das vias aéreas na interpretação dos resultados do teste. O TBP da metacolina pode ocasionalmente ser falsamente positivo após uma infecção por influenza ou infecção respiratória alta nas 4 semanas anteriores ao teste, imunizações, em pacientes muito jovens ou muito idosos, em pacientes com doença pulmonar crônica (p. ex., fibrose cística, sarcoidose, tuberculose, doença pulmonar obstrutiva crônica), em pacientes com rinite alérgica sem sintomas de asma e em fumantes ou em pacientes após exposição ao ar poluído.
➢ Um resultado para o teste de broncoprovocação pela metacolina é dado como negativo (normal) se após as doses com acréscimos de duplicação ou quadruplicação pela técnica de respiração corrente de 2 minutos, se detecta redução do VEF1 de < 20% após todas as doses administradas.
Os valores para a classificação da responsividade brônquica após o TBP da metacolina são apresentados na Tabela 3. Em relação à diretriz de 1999 da ATS ocorreram modificações.5 Se a PC20 > 16 mg/ml ou a PD20 > 400 µg, com alto grau de certeza se pode declarar que o paciente não tem atualmente asma.21,22 Em crianças um valor de PC20 ≤ 8 mg/ml deve ser considerado como um teste positivo.
Tabela 3 – Valores Normais para o Teste de Broncoprovocação da Metacolina5,11
PD20 µmol (µg) |
PC20 mg/ml |
Interpretação |
> 2 (>400) |
>16 |
Normal |
0,5–2,0 (100–400) |
4–16 |
HRB Borderline |
0,13–0,5 (25–100) |
1–4 |
HRB Moderada |
0,03–0,13 (6–25) |
0,25–1 |
HRB Moderada |
<0,03 (<6) |
<0,25 |
HRB Acentuada |
|
PC20 - concentração de estímulo para provocar queda de 20% no VEF1 (em relação ao basal); PD20 - dose de estímulo para provocar queda de 20% no VEF1 (em relação ao basal); HRB - hiper-responsividade brônquica
|
||
O fabricante de um nebulizador, dosímetro ou dispositivo integrado destinado ao teste de broncoprovocação com a metacolina deve fornecer um cronograma de concentrações e tempos de respiração corrente ou número de respirações em que se alcançará a liberação de doses adequadas de metacolina, ou deve fornecer dados suficientes da produção do aerossol — quanto ao fluxo, distribuição do tamanho de partículas, percentual de massa inalada, deposição estimada — para permitir a construção de um protocolo para cálculo de dosagem apropriada.
Para atingir os aumentos de dose apropriados, as concentrações progressivas devem ser escolhidas com base nas particularidades de desempenho do dispositivo de administração. Como o end-point é baseado na dose calculada se pode utilizar a Tabela 1 como orientação, onde são apresentadas as doses recomendadas por inalação de metacolina (Provocholine®) do teste de broncoprovocação incremental de duplicação e quadruplicação utilizando o nebulizador English Wright por 2 minutos.
➢ Um teste positivo confirma a hiper-responsividade brônquica e covalida um diagnóstico de asma brônquica. Todavia, se negativo em pacientes com sintomas respiratórios é uma indicação para se investigar outras patologias respiratórias como a bronquite eosinofílica, obstrução laringea induzível, síndrome de hiperventilação, asma ocupacional etc.23 No entanto, se a asma permanecer como um diagnóstico potencial, testes seriados são indicados.24
Teste de Broncoprovocação Utilizando o Manitol
Tem aumentado a utilização do manitol nos testes de broncoprovocação. O manitol induz a broncoconstrição através da alteração da osmolaridade do epitélio do trato respiratório superior. A variação da osmolaridade resulta na ativação e desgranulação dos mastócitos, bem como dos eosinófilos, mimetizando a inflamação ativa das vias respiratórias.25 Esta substância é aplicada através de um inalador de pó seco, utilizando-se doses progressivas que são duplicadas a cada inalação variando de 5 a 160 mg.
Como um teste de broncoprovocação indireto, o manitol não causa contração somente de forma direta do músculo liso brônquico, como o fazem a inalação da histamina e metacolina. O manitol atua indiretamente nas células inflamatórias, principalmente nos mastócitos, induzindo à liberação de mediadores como prostaglandina D2, leucotrieno E4 e histamina. Em indivíduos com hiper-responsividade à exposição a estes mediadores estimularão receptores específicos determinando a contração da musculatura lisa brônquica levando ao broncospasmo.
O protocolo mais utilizado é o de Anderson et al.26 Este protocolo consiste na inalação inicial de uma cápsula "vazia" que funciona como um placebo – medida basal; seguem-se inalações de 5, 10, 20, 40, 80, 160, 160 e 160 mg de manitol, alcançando-se uma dose cumulativa máxima total de 635 mg. As doses de 80 e 160 mg são administradas em múltiplos de cápsulas de 40 mg (2 x 40 e 4 x 40 mg).
Duas medidas do VEF1 são efetuadas cerca de 60 segundos após cada dose, retendo-se o valor mais alto do VEF1. Se o indivíduo apresenta uma queda do VEF1 > 10% em resposta a uma dose, esta é então repetida.
O teste de broncoprovocação é considerado positivo e interrompido quando ocorre uma queda de 15% no VEF1 ou uma redução de 10% no VEF1 entre duas doses consecutivas de manitol. É considerado negativo quando a dose cumulativa total de 635 mg é alcançada e o VEF1 não caiu ≥ 15% em relação ao valor basal. O VEF1 basal utilizado para calcular o percentual de queda do VEF1 é aquele medido inicialmente com a cápsula placebo (0 mg). O teste é bem tolerado, podendo causar tosse e/ou garganta seca, sendo um eventual broncospasmo revertido com inalação de 200 mcg de salbutamol.
O manitol PD15 pode ser usado para classificar a gravidade da hiper-responsividade indireta como leve >155 mg, moderada entre 35 e 155 mg ou grave ≤35 mg.27-29
O tempo médio para um teste de manitol positivo é < 18 min e para um teste negativo < 27 min. O teste de broncoprovocação é comercializado atualmente em 23 países utilizando pó seco, sob o nome Aridol® ou Osmohale®, tendo sido aprovado por autoridades da Europa, Ásia, Austrália e EUA.30
Os testes de provocação com manitol não são muito bem tolerados pelas crianças e devem ser evitados, utilizando-se outros testes de provocação.
Os testes indiretos incluem também os testes de hiperventilação eucápnica e induzidos por exercício. O objetivo desses testes é provocar uma 'desidratação' das vias respiratórias que estimule a secreção de várias citocinas e mediadores inflamatórios pelo epitélio brônquico e submucosa desencadeando contração hipersensível das células musculares lisas.31 Da mesma forma que o manitol a broncoconstrição induzida por exercício está associada à asma com boa especificidade, mas baixa sensibilidade.
Na Tabela 4 são sumarizados os critérios para se considerar positivo os vários testes de provocação.
Tabela 4 – Critérios para se Considerar Positivos os Índices de Broncoprovocação
Teste de Broncoprovocação
POSITIVO
Adultos: queda do VEF1 basal ≥ 20% com doses padrão de metacolina, ou ≥ 15% com hiperventilação padronizada, utilizando solução salina hipertônica ou manitol, ou > 10% e > 200 ml com provocação induzida por exercício.
Crianças: queda no VEF1 de ≥ 12% do previsto (ou queda no PFE > 15%) com provocação induzida por exercício padronizado.
Concluindo:
➮ Os testes diretos são sensíveis, mas não específicos para asma e, portanto, costumam ser usados para descartar hiper-responsividade das vias aéreas.32,33
➮ Os testes indiretos são menos sensíveis, porém mais específicos e, portanto, podem ser usados para diferenciar a asma de outras patologias pulmonares.32,33
Referências
01.Perpiñá M, Pellicer C, Diego A, Compte L, Macián V. Diagnostic value of the bronchial provocation test with mwthacholinne in asthma. A Bayesian analysis approach. Chest 1993; 104:149-54.
02.Hunt R, Taveau R de M. Bull US Hyg Lab 1911; 73:80.
03.Lee MK, Yoon HK, Kim SW, Kim TH, Park SJ, Lee YM. Nonspecific bronchoprovocation test. Tuber Respir Dis 2017; 80:344-350.
04.Davis BE, Blais CM, Cockcroft DW. Methacholine challenge testing: comparative pharmacology. J Asthma Allergy 2018; 11:89-99.
05. Crapo RO, Casaburi R, Coates AL, Enright PL, Hankinson JL, Irvin CG, MacIntyre NR, McKay RT, Wanger JS, Anderson SD, Cockcroft DW, Fish JE, Sterk PJ. Guidelines for methacholine and exercise challenge testing – 1999. Am J Respir Crit Care Med 2000; 161:309–329.
06. Cockcroft DW, Davis BE, Todd DC, Smycniuk AJ. Methacholine challenge: comparison of two methods. Chest 2005; 127:839–44.
07.Prieto L, Ferrer A, Pérez-Francés C. Effect of challenge method on sensitivity, reactivity and maximal response to methacholine. Ann Allergy Asthma Immunol 2006; 97:175–181.
08.Cockcroft DW, Davis BE. The bronchoprotective effect of inhaling methacholine by using total lung capacity inspirations has a marked influence on the interpretation of the test result. J Allergy Clin Immunol 2006; 117:1244–48.
09.Allen ND, Davis BE, Hurst TS, Cockcroft DW. Difference between dosimeter and tidal breathing methacholine challenge: contributions of dose and deep inspiration bronchoprotection. Chest 2005; 128:4018–23.
10.Prieto L, Lopez V, Llusar R, Rojas R, Marin J. Differences in the response to methacholine between the tidal breathing and dosimeter methods: influence of the dose of bronchoconstrictor agent delivered to the mouth. Chest 2008; 134:699–703
11.Coates AL, Wanger J, Cockcroft DW, Culver BH; Bronchoprovocation Testing Task Force: Kai-Håkon Carlsen, Diamant Z, Gauvreau G, Hall GL, Hallstrand TS, Horvath I, de Jongh FHC, Joos G, Kaminsky DA, Laube BL, Leuppi JD, Sterk PJ. ERS technical standard on bronchial challenge testing: general considerations and performance of methacholine challenge tests. Eur Respir J 2017; 49:1601526.
12.Sterk PJ, Fabbri LM, Quanjer PH, Cockcroft DW, O'Byrne PM, Anderson SD, Juniper EF, Malo JL. Airway responsiveness. Standardized challenge testing with pharmacological, physical and sensitizing stimuli in adults. Eur Respir J 1993; 6: Suppl. 16, 53–83.
13.Schmidt LE, Thorne PS, Watt JL, Schwartz DA. Is an abbreviated bronchial challenge with histamine valid? Chest 1992; 101:141–145.
14.Jörres RA, Nowak D, Kirsten D, Grönke L, Magnussen H. A short protocol for methacholine provocation testing adapted to the Rosenthal-Chai dosimeter technique. Chest 1997; 111:866–869.
15.Henderson JC, O'Connell F, Fuller RW. Decrease of histamine induced bronchoconstriction by caffeine in mild asthma. Thorax 1993; 48:824–826.
16.Wilson NM, Green S, Coe C, Barnes PJ. Duration of protection by oxitropium bromide against cholinergic challenge. Eur. J. Respir. Dis 1987; 71:455–458.
17.Derom EY, Pauwels RA, Van Der Straeten MEF. The effect of inhaled salmeterol on methacholine responsiveness in subjects with asthma up to 12 hours. J. Allergy Clin. Immunol 1992; 89:811–815.
18.Cockcroft DW, Swystun VA. Effect of single doses of S-salbutamol, R salbutamol, racemic salbutamol, and placebo on the airway response to methacholine. Thorax 1997; 52:845–848.
19.Sayeedi I, Widrich J. Methacholine challenge test. [Updated 2020 Dec 23]. In : StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2021 Jan-. Disponível em: https://www.ncbi.nlm.nih.gov/books/NBK547716/ Acesso em: 10 de junho de 2021.
20.Crapo RO, Casaburi R, Coates AL, Enright PL, Hankinson JL, Irvin CG, MacIntyre NR, McKay RT, Wanger JS, Anderson SD, Cockcroft DW, Fish JE, Sterk PJ. Guidelines for methacholine and exercise challenge testing – 1999. Am J Respir Crit Care Med 2000; 161:309–329.
21.Cockcroft DW, Hargreaves FE. Airway hyperresponsiveness relevance of random population date to clinical usefulness. Am Rev Respir Dis 1990; 142:497-500.
22.Holzer K, Anderson SD, Douglass JA. Exercise in elite summer athletes: challenges for diagnosis. J Allergy Clin Immunol 2002; 110:374–380.
23.Bohadana AB, Rokach A, Wild P, Izbicki G. Asthma-like symptoms induced by the methacholine challenge test: do they predict a negative-to-positive switch in the test result?-case report. J Thorac Dis 2018; 10:E716-E720. doi:10.21037/jtd.2018.09.63.
24.Cockcroft DW. Methacholine challenge testing in the diagnosis of asthma. Chest 2020; 158:433-434.
25.Hughes JMB, Interpreting pulmonary function tests. Breathe 2009; 6:103-110.
26.Anderson SD, Brannan J, Spring J, Spalding N, Rodwell LT, Chan K, Gonda I, Walsh A, Clark AR. A new method for bronchial-provocation testing in asthmatic subjects using a dry powder of mannitol. Am J Respir Crit Care Med 1997; 156:758-765.
27.Anderson SD, Brannan JD. Methods for “indirect” challenge tests including exercise, eucapnic voluntary hyperpnea, and hypertonic aerosols. Clin Rev Allergy Immunol 2003; 24:27–54.
28. Anderson SD. “Indirect” challenges from science to clinical practice. Eur Clin Respir J 2016; 3:31096.
29.Brannan JD, Anderson SD, Perry CP, Freed-Martens R, Lassig AR, Charlton B; Aridol Study Group. The safety and efficacy of inhaled dry powder mannitol as a bronchial provocation test for airway hyperresponsiveness: a phase 3 comparison study with hypertonic (4.5%) saline. Respir Res 2005; 6:144.
30.Anderson SD. Bronchial challange tests: usefulness, availability and limitations. Breathe 2011; 8:53-60.
31.Hallstrand TS, Leuppi JD, Joos G, Hall GL, Carlsen KH, Kaminsky DA, Coates AL, Cockcroft DW, Culver BH, Diamant Z, Gauvreau GM, Horvath I, de Jongh FHC, Laube BL, Sterk PJ, Wanger J; American Thoracic Society (ATS)/European Respiratory Society (ERS) Bronchoprovocation Testing Task Force. ERS technical standard on bronchial challenge testing: pathophysiology and methodology of indirect airway challenge testing. Eur Respir J 2018 Nov 15 ;52(5):1801033.
32.Comberiati P, Katial RK, Covar RA. Bronchoprovocation Testing in Asthma: An Update. Immunol Allergy Clin North Am 2018; 38:545-571.
33.Cockcroft DW. Direct challenge tests: Airway hyperresponsiveness in asthma: its measurement and clinical significance. Chest 2010; 138 (2 Suppl):18S-24S.
|
|
Próximo >> Características Patológicas |