|
Asma
TIPOS DE ASMA
ASMA PERIMENSTRUAL
Estima-se que aproximadamente 20% das mulheres apresentam piora de sua asma no período perimenstrual. Sanchez-Ramos et al.1 em revisão sistemática e metanálise, em 2017, concluíram que essas mulheres tendem a ser mais velhas, têm asma mais grave, com alto risco de exacerbações, maior índice de massa corporal, maior tempo de asma e maior probabilidade de doença respiratória exacerbada pela aspirina. Elas apresentam frequentemente mais síndrome dismenorreica, ciclos menstruais mais curtos e maior sangramento menstrual. O papel dos níveis hormonais e da inflamação sistêmica ainda permanece incerto.1
A piora da asma com aumento na variabilidade do Pico de Fluxo Expiratório (PFE) se desenvolve no período de dois a cinco dias que antecede a  menstruação (Figura 1). Na atualidade acredita-se que este tipo particular de asma ocorra em mulheres que já apresentem um certo grau de resistência aos corticoides. menstruação (Figura 1). Na atualidade acredita-se que este tipo particular de asma ocorra em mulheres que já apresentem um certo grau de resistência aos corticoides.
A asma nas crianças predomina no
sexo masculino variando de 3:2 a 2:1 com maior incidência de alergia (maior produção de IgE) e internações.2,3 Este índice passa a 1:1 nos primeiros anos da adolescência entre os 10 e 12 anos,4-7 entretanto, na idade adulta passa a ocorrer predomínio do sexo feminino, com asma mais grave, não alérgica.
Cerca de 25% dos casos se iniciam após a idade dos 40 anos, quando passa a preponderar no sexo feminino. A prevalência de asma atual em pessoas com mais de 65 anos foi documentada na Austrália entre 7,5 e 12,5%, com predominância do sexo feminino.8 Dados dos EUA sugerem taxas entre 4 e 10%, novamente para o sexo feminino.9
Hanley10 submeteu 102 pacientes com asma a um questionário avaliando a relação entre os sintomas de asma e o ciclo menstrual. Trinta e seis relataram piora por ocasião da menstruação, com redução significativa do PFE. Gibbs et al.11 em protocolo semelhante, medindo o PFE duas vezes ao dia, detectaram piora clínica e funcional em cerca de 40% das pacientes. Eosinófilos no escarro e a fração exalada do óxido nítrico (FeNO) são citados como significativamente aumentados durante a fase pré-menstrual em comparação com a fase imediatamente pós-catamenial, indicando variação cíclica na inflamação.12 Um estudo prospectivo com 182 mulheres entre 13 anos até a menopausa demonstrou aumento de até quatro vezes na frequência de visitas ao serviço de emergência, nos sete dias que antecediam a menstruação (quase 50% das visitas na fase perimenstrual),13 sendo que algumas pacientes necessitam de hospitalização e até suporte ventilatório mensal.14 Outras publicações, entretanto, como a de Zimmerman et al.15 evidenciaram que somente 28% das 288 visitas à emergência por exacerbação de asma aguda ocorreram na fase perimenstrual, enquanto que 33% na fase pré-ovulatória. Brenner et al.16 em estudo que incluiu 792 visitas de mulheres à emergência por asma aguda, obtiveram resultados que também divergiam dos de Skobeloff e cols., observando 28% das visitas na fase pré-ovulatória e 27% na perimenstrual.
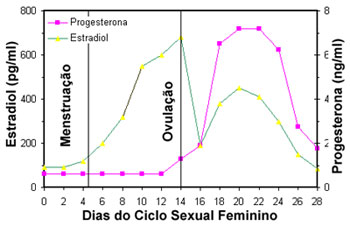 Nas mulheres em período fértil ocorrem alterações periódicas mensais nas taxas de secreção dos hormônios femininos. Este padrão rítmico é chamado de ciclo sexual feminino e dura em média 28 dias (Figura 2). Este ciclo, entretanto, pode ser de 20 dias ou atingir 45 dias mesmo em mulheres completamente normais. Durante o ciclo os níveis de estrogênios e de progesterona se elevam e caem. Sob a influência dos estrogênios, secretados em quantidades cada vez maiores pelos ovários durante a primeira parte do ciclo, ocorre a chamada fase proliferativa ou fase estrogênica, quando o endométrio aumenta muito a sua espessura. Durante a ovulação que ocorre no 14º–15º dias do ciclo acontece o pico de estrogênios. Posteriormente, na segunda metade do ciclo os estrogênios e a progesterona são secretados em grandes quantidades (porém mais progesterona) pelo corpo lúteo, sucedendo-se uma elevação mantida destes hormônios entre o 19º–25º dias do ciclo, cujo sinergismo causa considerável espessamento endometrial, que praticamente dobra durante a fase secretora do ciclo. Cerca de dois dias antes do término do ciclo o corpo lúteo involui subitamente, e os hormônios estrogênios e progesterona caem abruptamente a níveis de secreção muito baixos quando ocorre a menstruação, pondo fim ao ciclo ovariano. Nas mulheres em período fértil ocorrem alterações periódicas mensais nas taxas de secreção dos hormônios femininos. Este padrão rítmico é chamado de ciclo sexual feminino e dura em média 28 dias (Figura 2). Este ciclo, entretanto, pode ser de 20 dias ou atingir 45 dias mesmo em mulheres completamente normais. Durante o ciclo os níveis de estrogênios e de progesterona se elevam e caem. Sob a influência dos estrogênios, secretados em quantidades cada vez maiores pelos ovários durante a primeira parte do ciclo, ocorre a chamada fase proliferativa ou fase estrogênica, quando o endométrio aumenta muito a sua espessura. Durante a ovulação que ocorre no 14º–15º dias do ciclo acontece o pico de estrogênios. Posteriormente, na segunda metade do ciclo os estrogênios e a progesterona são secretados em grandes quantidades (porém mais progesterona) pelo corpo lúteo, sucedendo-se uma elevação mantida destes hormônios entre o 19º–25º dias do ciclo, cujo sinergismo causa considerável espessamento endometrial, que praticamente dobra durante a fase secretora do ciclo. Cerca de dois dias antes do término do ciclo o corpo lúteo involui subitamente, e os hormônios estrogênios e progesterona caem abruptamente a níveis de secreção muito baixos quando ocorre a menstruação, pondo fim ao ciclo ovariano.
Estudos relataram piora dos sintomas da asma, diminuição das taxas de PFE e aumento do uso de medicamentos de resgate em mulheres com asma durante a fase pré-menstrual ou perimenstrual do ciclo, correspondendo a baixos níveis de progesterona e estrogênio.17
No homem não existem estas variações dia a dia ou semana a semana. A testosterona alcança seu pico máximo na adolescência, ocorrendo então uma muito lenta e gradual redução nos níveis séricos até a terceira idade.
Acredita-se que estas oscilações hormonais na mulher sejam responsáveis pela maior tendência à asma brônquica. A hiper-responsividade brônquica está usualmente aumentada no período perimenstrual, apresentando-se exacerbada em pacientes sintomáticas. Baseados na flutuação dos níveis de estradiol, Skobeloff et al.13 dividiram o ciclo feminino em quatro, cada um deles com 7 dias de intervalo: pré-ovulatório (dias 5 a 11), periovulatório (dias 12 a 18), pós-ovulatório (dias 19 a 25) e perimenstrual (dias 26 a 4) e propuseram que a flutuação dinâmica do estrogênio após a elevação sustentada da segunda fase (secretória) do ciclo é que era a responsável pelas alterações nos mediadores inflamatórios nas vias aéreas. Este trabalho foi posteriormente confirmado por Cydulka e Emerman,18 que avaliaram 69 mulheres atendidas em um serviço de emergência universitário. Concluíram que não havia correlação entre os valores absolutos do estradiol sérico com a gravidade do broncospasmo, com a resposta ao broncodilatador ou com a admissão hospitalar para tratamento da asma e atribuíram a queda brusca dos níveis de estrogênio após o plateau pós-ovulatório como fator determinante para a asma perimenstrual.
Uma outra vertente relaciona a asma perimenstrual à queda da progesterona e à elevação da relação estrogênio-progesterona. Esta teoria baseia-se na hipótese de que a progesterona normalmente determina uma ação protetora, possivelmente anti-inflamatória nestas pacientes.
Sob o ponto de vista fisiopatológico, os hormônios sexuais esteroides modulam a estrutura e função das células brônquicas e imunológicas. A compreensão de seu papel na patogenia da asma é complicada por efeitos ambivalentes dos estrogênios broncodilatadores e pró-inflamatórios, desencadeando degranulação dos mastócitos, bem como pela diversidade de respostas a sua associação com a progesterona,
responsáveis pelo agravamento específico de muitos sintomas perimenstruais autoimunes diferentes,19,20 relacionados à dor, como cefaleia (enxaqueca), dores pélvicas21-23 e de condições inflamatórias específicas.24 Em contrapartida, o papel como estabilizador/regulador da testosterona e outros androgênios parece provável.25
Os hormônios sexuais femininos exercem efeitos importantes em vários mediadores (citocinas) e processos inflamatórios.
A maioria, senão todos, desses efeitos não foram testados em relação à asma ou ao agravamento perimenstrual da asma, mas podem ser relevantes. Os mecanismos que valem à pena considerar incluem os efeitos dos hormônios femininos na inflamação da mucosa brônquica.26 Dois receptores são descritos para estrogênios (ER) ERα e ERß acoplados à proteína G. As células epiteliais brônquicas humanas expressam ambos os receptores - ERα e ERß e são responsivas à exposição ao estrogênio.
O tratamento dessas células com estrogênio gera o NOS endotelial e consequente produção de óxido nítrico com broncodilatação como resultado.27 De modo igual, a mesma dose de estrogênio relaxa o músculo liso das vias aéreas e leva à broncodilatação.28 A maioria das células imunes expressa receptores de estrogênio (ERα, ERß ou o ER acoplado à proteína G ligado à membrana) em vários graus e pode responder ao hormônio. Isto significa dizer que a sinalização de estrogênio afeta praticamente todas as células do sistema imunológco.29
Como uma das características da asma perimenstrual é a ausência de resposta ao corticoide, mesmo em altas doses, embora responda a altas doses de progesterona,14 acredita-se que esta constatação derive de uma certa resistência, que deve ser regulada pelos níveis endógenos de hormônios sexuais femininos. Esta resistência parece decorrer de uma competição nos sítios de ligação dos receptores de corticoides (GR), pois os receptores de estrogênio e progesterona apresentam semelhanças estruturais com o GR.
Kalkhoveng et al.30 descreveram uma interação entre o receptor da progesterona e o fator de transcrição NF-kB (nuclear factor kB), sugerindo que uma queda na progesterona possa aumentar a ativação do NF-kB. Como os corticoides bloqueiam o NF-kB, e na asma perimenstrual ocorre resistência ao corticoide, isto pode indicar que exista excessiva formação de NF-kB nestas pacientes. O NF-kB é uma proteína necessária para máxima transcrição de muitas moléculas pró-inflamatórias que são importantes na geração da inflamação e em sua amplificação, incluindo moléculas de adesão intercelular como a ICAM-1, enzimas como a COX-2 e a i NOS e a maior parte das citocinas como IL-1ß , TNF-a , IL-6 e quimiocinas como a IL-8, RANTES, MCP-1, MIP-1a e Eotaxina.31-33 O NF-kB é também importante na ativação de células T, na upregulation da IL-2 e receptores IL-2.34
A associação de asma perimenstrual com a doença respiratória exacerbada pela aspirina é especialmente intrigante.35 A aspirina e os anti-inflamatórios não hormonais (AINHs) inibem a ciclo-oxigenase (COX), diminuindo a geração de prostaglandinas (PGs), que estão fortemente relacionadas à menstruação. Na fase perimenstrual com a queda progressiva da progesterona a PGE2 se eleva antes e durante a menstruação, o que causa vasodilatação e favorece o edema endometrial.36 Já a PGF2α, um potente vasoconstritor, aumenta no endométrio perimenstrual no início da menstruação.37 Todavia, reduções nos aumentos perimenstrual associados ao PGE2 podem afetar negativamente a asma através da perda de níveis de proteção de PGE2.38-40 Por outro lado o reconhecimento de maior sensibilidade à aspirina em mulheres com asma perimenstrual pode representar uma agravante, pelo uso de AINHs para tratamento de sintomas dismenorreicos, apesar de Forbes et al.35 não terem encontrado associação em uma pequena amostra de pacientes com asma leve.
Outra possibilidade relaciona-se às anormalidades no desempenho dos beta-receptores. Trabalhos demonstram que na asma perimenstrual ocorre redução no número de ß2-receptores em linfócitos circulantes, sugerindo que a resposta aos broncodilatadores ß2-agonistas possa estar deprimida nestas pacientes.41 Há algum tempo já sabemos que a progesterona determina upregulation dos receptores beta-adrenérgicos em mulheres sadias, quando os níveis de estrogênio são mantidos em níveis normais.41 Tan et al.42 demonstraram que, na mulher adulta com asma, a progesterona causa uma downregulation paradoxal dos receptores beta nos linfócitos. Esta downregulation dos receptores ocasiona uma baixa resposta do AMPc ao isoproterenol e outros ß-agonistas. Estes autores chegaram a propor que este efeito paradoxal da progesterona em pacientes com asma seria a causa determinante para um mau funcionamento dos receptores beta-adrenérgicos, ocasionando a asma perimenstrual, quando os níveis de progesterona encontram-se elevados na fase secretória do ciclo que antecede a menstruação.42
A asma pré-menstrual é considerada na atualidade como um "marcador" de doença severa, ocorrendo maior número de hospitalizações neste grupo.43 Existem relatos de morte súbita por asma pré-menstrual, sendo que uma publicação menciona a morte em duas irmãs.44
Tratamento
O tratamento da asma perimenstrual é o mesmo proposto pelos guidelines. Entretanto, algumas mulheres devido à gravidade da doença, podem necessitar, na segunda metade do ciclo menstrual, de um aumento na dose de corticoide por inalação ou da adição de um broncodilatador ß2-agonista de longa ação.45 Os antagonistas de receptor de leucotrienos também podem ser úteis.
Existem relatos de boa resposta ao uso de elevadas doses de progesterona intramuscular nas exacerbações severas de asma perimenstrual resistente aos corticoides sistêmicos.14 Esta modalidade de tratamento é capaz de eliminar as quedas do PFE e permite reduções nas doses de corticoides sistêmicos.
A utilização de pílulas anticoncepcionais se faz há longa data na asma quando as pacientes não conseguem controle com o tratamento convencional. Tan et al.46 em uma avaliação de 18 mulheres com asma e em uso de contraceptivo oral não observaram mudanças significativas na responsividade brônquica ao longo do ciclo hormonal, ao contrário daquelas que não faziam uso de pílula anticoncepcional, quando ocorria aumento da responsividade das vias aéreas durante a fase lútea do ciclo. A pílula anticoncepcional promove a supressão da elevação dos hormônios sexuais na fase lútea do ciclo normal, atenuando as variações da responsividade das vias aéreas, com consequente redução na variabilidade do PFE.46 Murphy e Gibson47 avaliaram os efeitos do uso de anticoncepcionais orais e a relação entre asma perimenstrual e os sintomas pré-menstruais. Foram acompanhadas 28 mulheres com asma, prospectivamente por pelo menos 12 semanas ao longo de 2–4 ciclos menstruais consecutivos. Concluíram que os anticoncepcionais não proporcionam proteção e a utilização de medicamentos de alívio aumentou em 57%.
Nwaru e Sheikh48 utilizando o Optimum Patient Care Research Database
(OPCRD), um banco de dados de cuidados primários do Reino Unido, efetuaram um estudo de coorte aberto retrospectivo de mulheres na idade reprodutiva, entre 16 a 45 anos de idade (n = 564.896) acompanhadas entre os anos 2000 e 2016. Concluíram após análise dos registros para o risco substancialmente reduzido de casos novos de asma observado em mulheres que usam contraceptivos hormonais em comparação àquelas que não usam. Isto fornece evidência mais clara para um impacto relevante dos anticoncepcionais hormonais quanto à prevenção primária da asma em mulheres em idade reprodutiva.
Não são muitos os estudos que avaliam a pílula anticoncepcional para o tratamento da asma pré-menstrual. Nestes estudos, as amostras são pequenas, sem um controle adequado dos vários medicamentos utilizados, sendo a apreciação do status alérgico muitas vezes falho. Não existem estudos comparando sintomas ou função pulmonar com as várias doses administradas ou tipo de contraceptivo hormonal oral utilizado. Entretanto, parece não haver dúvida de que este tipo de terapêutica pode eliminar as flutuações hormonais do ciclo feminino.
Embora existam fundamentos para que o tratamento hormonal com anticoncepcionais possa ser instituído no tratamento da asma, são necessárias mais evidências para apoiar esta conduta. No entanto, teremos de avaliar o risco-benefício, equilibrando o risco de eventos adversos à terapia hormonal, que apresenta o potencial de efeitos colaterais cardiovasculares graves.49-53 É bem estabelecida a maior tendência à trombose.51-53 Esse risco varia de acordo com o tipo do estrogênio e a quantidade de progestogênio.51 A doença cerebrovascular que inclui o acidente vascular cerebral isquêmico e o acidente vascular hemorrágico junto à doença coronariana isquêmica têm maior probabilidade de ocorrer em quem faz uso de anticoncepcionais orais.50,52
Apesar das pílulas anticoncepcionais evoluírem para muitos formatos diferentes, podem apresentar, além do já descrito, outros efeitos colaterais e riscos como ganho de peso e distúrbios de humor (labilidade emocional e depressão).54,55
Pode-se concluir que as estratégias atuais de tratamento para a asma são muito mais seguras do que os anticoncepcionais hormonais, embora mais pesquisas sejam necessárias.
Referências
01.Sanchez-Ramos JL, Pereira-Vega AR, Alvarado-Gomez F, Maldonado-Perez JA, Svanes C, Gomez-Real F. Risk factors for premenstrual asthma: a systematic review and meta-analysis. Expert Rev Respir Med 2017;11:57-72.
02.Wijga A, Tabak C, Postma DS, et al. Sex diferences in asthma during the first 8 years of life: the Prevention and Incidence of Asthma and Mite Allergy (PIAMA) birth cohort study. J Allergy Clin Immunol 2011; 127:275-7.
03.Dawson B, GH, Illsley R, G Horobin, R Mitchell. Survey of childhood asthma in Aberdeen. Paediatr Res Soc 1962; 1:135-6.
04.Brenner BE, Holmes TM, Mazal B, Camargo CA Jr.
Relation between phase of the menstrual cycle and asthma presentations in the emergency department. Thorax 2005; 60:806-9.
05.Skobeloff EM1, Spivey WH, St Clair SS, Schoffstall JM.
The influence of age and sex on asthma admissions. JAMA.1992; 268:3437-40.
06.Becklake MR, Kauffmann F. Gender difference in airway behaviour over the human life span. Thorax 1999; 54:1119-38.
07.Lieberoth S, Gade EJ, Brok J, Backer V, Thomsen SF.
Age at menarche and risk of asthma: systematic review and metaanalysis. J Asthma 2014; 51:559-65.
08.Australian Centre for Asthma Monitoring (ACAM) Disponível em: www.asthmamonitoring.org Acesso em 05 de agosto de 2021.
09.Akinbami LJ, Moorman JE, Liu X. Asthma prevalence, health care use, and mortality United States, 2005-2009. Hyattsville: National Center for Health Statistics; 2011. National Health Statistics Reports, No 32.
10.Hanley SP. Asthma variation with menstruation. Br J Dis Chest 1981; 75:306-8.
11.Gibbs CJ, Coutts II, Lock R, Finnegan OC, White RJ. Premenstrual exacerbation of asthma. Thorax 1984; 39:833-36.
12.Oguzulgen IK, Turktas H, Erbas D. Airway inflammation in premenstrual asthma. J Asthma 2002; 39:517-22.
13.Skobeloff EM, Spivey WH, Silverman R, Eskin BA, Harchelroad F, Alessi TA. The effect of the menstrual cycle on asthma presentations in the emergency department. Arch Intern Med 1996; 156:1837-40.
14.Beynon H, Garbett N, Barnes PJ. Severe premenstrual exacerbations of asthma. Effect of intramuscular progesterone. Lancet 1988; 2:370-2.
15.Zimmerman JL, Woodruff PG, Clark S, Camargo CA.
Relation between phase of menstrual cycle and emergency department visit for acute asthma. Am J Respir Crit Care Med 2000; 162:512-5.
16.Brenner BE, Holmes TM, Mazal B, et al. Relation between phase of the menstrual cycle and asthma presentations in the emergency department. Thorax 2005; 60:806-9.
17.Thornton J, Lewis J, Lebrun CM, et al. Clinical characteristics of women with menstrual-linked asthma Respir Med 2012; 106:1236-43.
18.Cydulka RK, Emerman CL. Serum estradiol levels in women with acute exacerbations of asthma
(abstract). Acad Emerg Med 1997; 4:481.
19.Rubtsova K, Marrack P, Rubtsov AV. Sexual dimorphism in autoimmunity. J Clin Invest 2015; 125:2187-93.
20.Zandman-Goddard G, Peeva E, Shoenfeld Y. Gender and autoimmunity. Autoimmun Ver 2007; 6:366-72.
21.Martin VT, Lipton RB. Epidemiology and biology of menstrual migraine. Headache 2008; 48 Suppl 3:S124-30.
22.Graziottin A, Skaper SD, Fusco M. Inflammation and Chronic Pelvic Pain: A Biological Trigger for Depression in women? J Depress Anxiety 2013; 3:142-50.
23.Hassan S, Muere A, Einstein G. Ovarian hormones and chronic pain: Acomprehensive review. Pain 2014; 155:2448-60.
24.Heitkemper MM, Cain KC, Jarrett ME, Burr RL, Hertig V, Bond EF. Symptoms across the menstrual cycle in women with irritable bowel syndrome. Am J Gastroenterol 2003; 98:420-30.
25.Raherison C, Hamzaoui A, Nocent-Ejnaini C, Essari L-A, Ouksel H. et al. Asthme de la femme au fil du temps : vers une prise en charge personnalisée ? Rev Mal Respir 2020; 34:144-160.
26.Vrieze, A., Postma, D. S., and Kerstjens, H. A. Perimenstrual asthma: a syndrome without known cause or cure. J. Allergy Clin. Immunol 2003; 112:271-282.
27.Townsend EA, Meuchel LW, Thompson MA, Pabelick CM, Prakash YS. Estrogen increases nitric-oxide production in human bronchial epithelium . J Pharmacol Exp Ther 2011; 339:815–24.
28.Townsend EA, Thompson MA, Pabelick CM, Prakash YS. Rapid effects of estrogen on intracellular Ca2+ regulation in human airway smooth muscle . Am J Physiol Lung Cell Mol Physiol 2010; 298:L521–30.
29.Keselman A, Heller N. Estrogen Signaling Modulates Allergic Inflammation and Contributes to Sex Differences in Asthma. Front Immunol. 2015; 6:568. Published 2015 Nov 16. doi:10.3389/fimmu.2015.00568
30.Kalkhoveng E, Wissink S, Van Der Saag PT, Van Der Burg B. Negative interaction between the Rel A (p65) subunit of NF- k B and the progesterone receptor. J Biol Chem 1996; 271:6217.
31.Blackwell TS, Christman JW. The role of nuclear factor kappa B in cytokine gene regulation. Am J Respir Cell Mol Biol 1997; 17:3-9.
32.Blackwell TS, Lancaster LH, Christman JW. Nuclear factor kappa B: a pivotal role in the systemic response syndrome and new target for therapy. Intensive Care Med 1998; 24:1131-8.
33.Siebenlist U, Franzoso G, Brown K. Structure, regulation and function of NF-kB. Ann Rev Cell Biol 1994; 10:405-55.
34.Lenardo MJ, Baltimore D. NF- k B: a pleiotropic mediator of inducible and tissue-specific gene control. Cell 1989; 58:227-9.
35.
Forbes L, Jarvis D, Bumey P. Is pre-menstrual asthma related to use of aspirin or non-steroidal anti-inflammatory drugs? Respir Med 2000; 94:828-829.
36.Maybin JA, Critchley HO. Progesterone: a pivotal hormone at menstruation . Ann N Y Acad Sci. 2011; 1221:88-97.
37.Milne SA, Jabbour HN. Prostaglandin (PG) F(2alpha) receptor expression and signaling in human endometrium: role of PGF(2alpha) in epithelial cell proliferation . J Clin Endocrinol Metab 2003; 88:1825-1832.
38.Mathé AA, Hedqvist P. Effect of prostaglandins F2 alpha and E2 on airway conductance in healthy subjects and asthmatic patients. Am Rev Respir Dis 1975; 111:313-320.
39.Szczeklik A, Mastalerz L, Nizankowska E, Cmiel A. Protective and bronchodilator effects of prostaglandin E and salbutamol in aspirin-induced asthma. Am J Respir Crit Care Med 1996; 153:567-571.
40.Walters EH, Davies BH. Dual effect of prostaglandin E2 on normal airways smooth muscle in vivo. Thorax 1982; 37:)918-922.
41.Tan KS, McFarlane LC, Coutie WJ, Lipworth BJ. The effect of exogenous female sex hormones on lymphocyte Beta 2 -adrenenoceptors in normal females. Br J Clin Pharmacol 1996; 41:414-6.
42.Tan KS, McFarlane LC, Lipworth BJ. Beta 2 adrenoceptor regulation and AMP reactivity during the menstrual cycle in female asthmatics. Thorax 1995; 50(suppl): A60.
43.Eliasson O, Scherzer HH, De Greff AC. Morbidity in asthma in relation to the menstrual cycle. J Allergy Clin Immunol 1986; 77:87-94.
44.Barkman RP. Sudden death in asthma. Med J Aust 1981; 1:316-7.
45.Tan KS. Premenstrual asthma: epidemiology, pathogenesis and treatment. Drugs 2001; 64:2079-86.
46.Tan KS, McFarlane LC, Lipworth BJ. Modulation of airway reactivity and peak flow variability in asthmatics receiving the oral contraceptive pill. Am J Respir Crit Care Med 1997; 155:1273-7.
47.Murphy VE, Gibson PG. Premenstrual asthma: prevalence, cycle-to-cycle variability and relationship to oral contraceptive use and menstrual symptoms. J Asthma 2008; 45:696-704.
48.Nwaru BI, Pillinger R, Tibble H, Shah SA, Ryan D, Critchley H, Price D, Hawrylowicz CM, Simpson CR, Soyiri IN, Appiagyei F, Sheikh A. Hormonal contraceptives and onset of asthma in reproductive-age women: Population-based cohort study.J Allergy Clin Immunol 2020; 146:438-46.
49.Barr, N. Managing adverse effects of hormonal contraceptives. Am Fam Physician 2010; 82:1499-1506.
50.Lidegaard Ø. Løkkegaard E. Jensen A. et al. Thrombotic stroke and myocardial infarction with hormonal contraception. N Engl J Med 2012; 366:2257-2266.
51.de Bastos M, Stegeman BH, Rosendaal FR, Van Hylckama Vlieg A, Helmerhorst FM, Stijnen T, Dekkers OM. Combined oral contraceptives: venous thrombosis. Cochrane Database of Systematic Reviews 2013, Issue 11. Art. No.: CD010813. DOI: 10.1002/14651858.CD010813. Acesso em: 26 agosto 2021.
52.Roach RE, Helmerhorst FM, Lijfering WM, Stijnen T, Algra A, Dekkers OM. Combined oral contraceptives: the risk of myocardial infarction and ischemic stroke. Cochrane Database of Systematic Reviews 2015, Issue 8. Art. No.: CD011054. DOI: 10.1002/14651858.CD011054.pub2. Acesso em: 26 Agosto 2021.
53.Horton LG, Simmons KB, Curtis KM. Combined hormonal contraceptive use among obese women and risk for cardiovascular events: A systematic review. Contraception 2016; 94:590-604.
54.Poromaa IS, Segebladh B. Adverse mood symptoms with oral contraceptives. Acta Obstet Gynecol Scand 2012; 91:420-7.
55.Skovlund CW, Mørch LS, Kessing LV, Lidegaard Ø. Association of Hormonal Contraception With Depression. JAMA Psychiatry 2016; 73:1154-1162.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|