|
Asma
ASMA NO IDOSO
INTRODUÇÃO
A longevidade constitui-se no maior triunfo da humanidade e em um de seus maiores desafios. A Organização Mundial de Saúde (OMS) descreve como idoso qualquer pessoa acima de 60 anos de idade, embora nem sempre a idade cronológica seja um marcador preciso para as mudanças que acompanham o envelhecimento, pois o processo de envelhecimento é contínuo e sem limites definidos — dissociação entre idades biológica e cronológica. Existem importantes variações no estado de saúde, participação e nível de independência entre pessoas mais velhas e da mesma idade.
Segundo a OMS a proporção da população de ≥ 60 anos cresce mais rapidamente do que  qualquer outro grupo etário. Em 2019, o número de pessoas no mundo com ≥ 60 anos era de 1 bilhão. Esse número aumentará para 1,4 bilhão em 2030 e 2,1 bilhões em 2050. O aumento está ocorrendo em um ritmo sem precedentes e irá avançar ainda mais nas próximas décadas, especialmente nos países em desenvolvimento,1 se observa uma tendência de envelhecimento da população mundial nos últimos anos. Isto acontece em função tanto do aumento da expectativa de vida pela melhoria nas condições de saúde quanto pela questão da taxa de fertilidade, visto que o número médio de filhos por mulher vem se reduzindo. qualquer outro grupo etário. Em 2019, o número de pessoas no mundo com ≥ 60 anos era de 1 bilhão. Esse número aumentará para 1,4 bilhão em 2030 e 2,1 bilhões em 2050. O aumento está ocorrendo em um ritmo sem precedentes e irá avançar ainda mais nas próximas décadas, especialmente nos países em desenvolvimento,1 se observa uma tendência de envelhecimento da população mundial nos últimos anos. Isto acontece em função tanto do aumento da expectativa de vida pela melhoria nas condições de saúde quanto pela questão da taxa de fertilidade, visto que o número médio de filhos por mulher vem se reduzindo.
Em 1980, apenas 4,0% da população brasileira tinha 65 anos ou mais. Em 2022 com uma população na segunda apuração do censo em
203.080.756 habitantes, esse grupo alcançou 10,9%, representando o maior percentual já registrado nos Censos Demográficos. No outro extremo, a proporção de crianças com até 14 anos, que era de 38,2% em 1980, se reduziu para 19,8% em 2022. Isto espelha o envelhecimento populacional, ou seja, a diminuição da proporção de jovens na população em contraste com o aumento da proporção de idosos.2 O Censo 2022 mostrou um aumento de 57,4% na população com ≥ 65 anos, que representa 10,9% da população total. Em 2010, esse grupo correspondia a apenas 7,4%.3
Para citar outro exemplo,
atualmente o Japão tem uma das populações mais idosas do mundo. Para uma população estimada em 2024 de aproximadamente 123,75 milhões de habitantes, 29,78% representando 36,85 milhões de pessoas têm ≥ 60 anos (1 em cada 3 indivíduos no Japão tem mais de 60 anos), se contrapondo aos 11,44% da população jovem entre 0 a 14 anos.4
No passado, a asma era considerada principalmente uma doença infantil; entretanto, vários estudos em populações europeias, norte-americanas e australianas mostraram que a prevalência da asma entre pessoas com mais de 65 anos varia de 4,5% a 12,7%.5-12
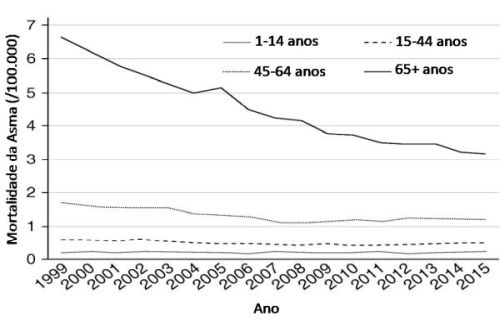
Pennington et al.13 avaliaram a mortalidade relacionada à asma no período de 1999 a 2015 nos Estados Unidos e puderam observar que a incidência geral diminuiu de 2,1 para 1,2 por 100.000 pessoas neste período, dividindo a população estudada em três grupos de idade: 1–14, 15–44, 45–64 e > 65 anos. Estratificaram também por gênero e raça. A taxa de mortalidade geral foi de 1,5 por 100.000. A incidência geral de mortalidade por asma diminuiu de 2,1 em 1999 para 1,2 em 2015 por 100.000 (43%; p < 0,001). A mortalidade em pacientes com mais de 65 anos diminuiu de 7,0 para 3,2 (54%; p < 0,001) (Figura 1). Provavelmente esta redução na mortalidade espelha progressos no diagnóstico e tratamento que vieram a influenciar neste declínio. A mortalidade em mulheres continuou a exceder a mortalidade em homens em cerca de duas vezes.13
Como acontece com muitas doenças, o processo de diagnóstico da asma em idosos geralmente pode ser feito por meio de uma história detalhada. Embora não precise ser necessariamente longo, deve ser extenso o suficiente para incluir não apenas perguntas que confirmem se a condição respiratória é realmente asma, mas também para descartar outras causas menos prováveis de dispneia e para considerar se as condições coexistentes estão tornando a asma do paciente pior.
Algumas patologias, com maior frequência, mimetizam a asma. A doença pulmonar obstrutiva crônica (DPOC) nos adultos talvez seja a mais comum. Embora ambas possam coexistir (> 10% dos pacientes com asma têm características de DPOC), às vezes torna-se um desafio para o clínico distingui-las. Ambas apresentam semelhanças entre si, pois são doenças crônicas, apresentam inflamação com limitação ao fluxo aéreo, causam broncoconstrição e consequente dispneia, acometem as pequenas vias aéreas e secretam muco.
Asma e DPOC são duas doenças inflamatórias crônicas que, quando estão combinadas, recebem a denominação de Síndrome de Sobreposição Asma e DPOC (ACOS), nomenclatura incluída nos últimos Consensos Internacionais de Doenças Respiratórias. As discussões sobre a história natural da DPOC remontam à década de 1960, quando surgiu a chamada hipótese holandesa.14 Esta enfatiza o papel da hipersensibilidade na modulação da resposta das vias aéreas à exposição a irritantes. Nesta teoria, a suscetibilidade foi proposta como relacionada em grande parte às características do paciente associadas à alergia e manifestada parcialmente por sibilos. Os asmáticos que têm asma desde a infância e que apresentam fatores de risco como tabagismo ou exposição a combustível de biomassa tendem a desenvolver características semelhantes à DPOC nos seus últimos anos de vida. Este é um fenótipo de pacientes que podem ter ACOS.15
A ACOS torna-se cada vez mais prevalente de acordo com o aumento da idade e a história de tabagismo, dando a impressão de que com a idade existe uma progressão da obstrução reversível das vias aéreas dos asmáticos mais jovens para obstrução mais irreversível dos pacientes mais velhos com DPOC.
Há um amplo consenso de que pacientes com características de asma e DPOC (ACOS) apresentam exacerbações frequentes,16,17 têm pior qualidade de vida,16,18 um maior declínio na função pulmonar, maior mortalidade17,19 e maior uso de recursos de saúde em comparação com pacientes com asma ou DPOC isoladamente.16,20
O não diagnóstico da asma, que é um problema em todos os grupos etários, é maior nos idosos, pois o tempo em anos de doença não detectada é superior. Esses pacientes tendem a ter uma percepção insuficiente de seus sintomas e são subdiagnosticados e subtratados. Muitos fatores podem tornar mais difícil o diagnóstico, dentre eles:
Sintomas não específicos também referidos por outras doenças (p.ex. DPOC, ICC)
Outras doenças mimetizando os sintomas da asma (p.ex. embolia pulmonar, refluxo gastresofagiano, obstrução endobrônquica e de vias respiratórias altas etc.)
Dificuldades na distinção entre asma e DPOC, principalmente em fumantes e ex-fumantes
Menor percepção da dispneia pelo idoso e consequente retardo na procura de cuidados médicos
Baixa utilização nesta faixa etária de testes espirográficos
Declínio significativo da função cognitiva, efeitos psicossociais do envelhecimento
Menor probabilidade de atopia no idoso
Achar que todos os sintomas estão relacionados à velhice
Habilidades motoras prejudicadas
A asma do idoso está relacionada a um fenótipo mais grave em comparação aos pacientes mais jovens, com obstrução mais severa e celularidade mais neutrofílica, podendo ser classificada em dois grupos:
1) Asma recorrente, com início na infância, que persiste ou volta a se manifestar durante e após a meia-idade, havendo relatos de retorno da doença aos 80 ou mesmo aos 90 anos de idade21-24 e;
2) Asma de início tardio, após os 65 anos25 de idade ou posterior,
parece ser mais grave e menos atópica, associada a um declínio da função pulmonar mais rápido — os asmáticos mais velhos apresentam 2,7 vezes mais probabilidade de ter “asma grave”, neutrofílica, em comparação aos pacientes adultos jovens com asma.26
Efeitos do Envelhecimento na Estrutura Pulmonar e Sua Função
Com o envelhecimento normal a rede de fibras de colágeno que envolve os ductos alveolares se altera,27 produzindo sua dilatação e a ampliação homogênea dos espaços alveolares. Esta dilatação dos espaços aéreos distais aos bronquíolos respiratórios, do envelhecimento normal do pulmão, difere do enfisema, porque não há inflamação associada ou destruição da parede alveolar. O aumento do espaço alveolar, entretanto, diminui a tensão superficial e, por sua vez, reduz a pressão elástica de retração. A coluna vertebral contribui para a cifose e, em combinação com a convexidade do esterno, aumenta o diâmetro anteroposterior do tórax. Ao mesmo tempo, o comprimento da parede torácica diminui devido às alterações degenerativas da coluna vertebral e maior rigidez da caixa torácica, somada à calcificação nas articulações condrocostais e redução da espessura dos músculos parietais, com redução da complacência da parede torácica. A força muscular respiratória se deteriora devido à diminuição da curvatura do diafragma, à sarcopenia e à inadequada nutrição.28-32
A redução na pressão de retração elástica diminui os fluxos expiratórios, incluso o Pico de Fluxo Expiratório (PFE). Em não fumantes saudáveis, existe um decréscimo anual de 30 ml no Volume Expiratório Forçado no primeiro segundo (VEF1) após os 30 anos,27,33,34 com declínio mais acelerado em ambos VEF1 e Capacidade Vital Forçada (CVF) entre 65 e 93 anos.35 A relação VEF1/CVF também diminui com o envelhecimento e a Curva Fluxo-Volume se apresenta com aspecto obstrutivo.36 O Volume Residual (VR) aumenta em cerca de 50% entre as idades de 20 e 70 anos como resultado do fechamento precoce das vias aéreas, secundário à redução da pressão de retração elástica pulmonar, associado à redução na complacência da parede torácica e redução na força muscular. Aos 65 anos o Volume de Fechamento (VF) se aproxima da Capacidade Residual Funcional (CRF), podendo as vias aéreas se fecharem durante o ciclo respiratório.
No paciente idoso com asma, as alterações patológicas da asma se associam com as do envelhecimento normal para afetar a estrutura e a função pulmonar. Isso pode evoluir para doença mais grave e difícil de controle (Tabela 1).37
Tabela1 — Asma no Idoso – Efeitos Devidos à Idade e à Asma
ASMA NO IDOSO |
EFEITOS DEVIDO À IDADE |
EFEITOS DEVIDO À ASMA |
∎ Alargamento do espaço alveolar |
∎ Pressão de retração elástica |
∎ Redução da complacência parede/coluna |
∎ Aumento da inflamação de vias aéreas |
∎ Redução da pressão de retração elástica |
∎ Aumento do remodelamento brônquico |
∎ Fechamento prematuro das vias aéreas e
|
|
Diagnóstico
O diagnóstico da asma no idoso é similar ao de qualquer outra faixa de idade. É baseado na anamnese, na presença de sinais e sintomas típicos da doença (dispneia, sibilos, opressão torácica e tosse) e nos exames da função pulmonar. Existem, entretanto, certas peculiaridades que devem ser salientadas.
▶ O papel da predisposição genética na asma de início na idade adulta é menos claro do que na asma de início na infância atópica. Na asma de início na idade adulta geralmente não há história familiar de asma e a atopia não é mais comum do que na população em geral.38
▶ O tempo médio de infecção pelo rinovírus, que em crianças e adultos oscila entre 9,5 e 11 dias, é mais longo no idoso alcançando 16 dias.39
▶ Os eventos que desencadeiam exacerbações agudas de asma em qualquer idade são os mesmos, porém a sensibilidade aos alérgenos inalados é menos prevalente no idoso, especialmente na asma de início tardio. A asma no idoso parece ser por natureza menos alérgica. A proporção de pacientes com asma que são atópicos varia inversamente com a idade: 80% nas crianças, 50% entre 20-40 anos e menos de 20% após os 50 anos.40
▶ A associação da asma com marcadores alérgicos não é clara no idoso. Pacientes idosos quase não demonstram sensibilidade aos aeroalérgenos nos testes cutâneos.41 Os testes cutâneos positivos foram relatados em uma porcentagem variável de adultos mais velhos, variando de 8% a 12%.27
▶ A frequência de testes cutâneos positivos no idoso com asma é menor do que no jovem, entretanto, é mais frequente no velho com asma do que no idoso sem a doença.42
▶ A IgE sérica total e a eosinofilia discriminam melhor a asma no idoso do que os testes cutâneos.42-44
▶ A inflamação neutrofílica, similar à encontrada na DPOC e na asma severa não eosinofílica, está presente nas vias aéreas de pacientes idosos com asma. Este tipo de inflamação pode estar relacionado à longa exposição a antígenos ambientais da poluição atmosférica e fumaça do cigarro.
▶ Mudanças fisiológicas que ocorrem no pulmão com o progredir da idade podem interagir com aquelas relacionadas à fisiopatologia da asma, agravando-a.
▶ A asma é frequentemente desencadeada nos pacientes idosos pelo uso de ß-bloqueadores prescritos para doenças cardiovasculares, que são mais prevalentes neste grupo etário, como a hipertensão arterial, a insuficiência coronariana e tratamento de arritmias. Sob a forma de colírios, os ß-bloqueadores são administrados para o tratamento da hipertensão intraocular, havendo relatos de parada respiratória em decorrência de sua absorção sistêmica45 e morte por asma.46
▶ É difícil saber exatamente se uma condição está causalmente relacionada ou é apenas uma comorbidade ou um fator desencadeante. Por exemplo, a obesidade é uma condição comorbida, mas também é um fator desencadeante para o surgimento da asma.38
▶ Apresentam maior morbidade e mortalidade. Pacientes com compreensão insuficiente da doença. Apresentam com frequência problemas cognitivos e sensoriais (perda de audição e visão). Má adesão ao tratamento. Polifarmácia.
A avaliação funcional pulmonar é necessária para o diagnóstico da doença, quantificação da obstrução, diagnóstico das exacerbações e modulação do tratamento. Todavia, existem dificuldades na realização da espirometria em idosos, principalmente pela prevalência importante de deficiências cognitivas. Testes de cognição foram avaliados como preditores de inaptidão para realizar a espirometria em idades avançadas.47,48 O exame mais adequado é a espirometria através da avaliação da CVF e do VEF1 e o VEF6 que se mostrou útil nestes pacientes onde uma completa expiração para obter uma CVF válida pode ser tarefa difícil.49 A utilização do VEF6 como substituto da CVF tem a vantagem de exigir uma manobra mais fácil e rápida, com menor esforço físico para os pacientes. O PFE deve ser utilizado para a monitorização ambulatorial.
A espirometria normal não afasta a hipótese de asma. Todavia, nesta eventualidade deve ser efetuada a broncoprovocação com o teste de metacolina. Contudo, para se submeter ao teste, o paciente deve ser capaz de realizar uma espirometria confiável.
Por outro lado, o PFE pode ser utilizado para a monitorização domiciliar do paciente. Apresenta utilização prática ainda para diagnóstico no cálculo da variabilidade diurna na asma do idoso, com avaliações seriadas do PFE durante o dia.50
A Capacidade de Difusão pelo Monóxido de Carbono (DLCO) pode ser utilizada na diferenciação entre a asma e o enfisema, principalmente nos idosos fumantes. Como o enfisema não é uma característica da asma de longa data em idosos, a DLCO deve ser normal, pode ser útil para discriminar a asma do enfisema.51
A geração de força pelos músculos respiratórios pode se tornar reduzida com a idade devido às mudanças degenerativas, às alterações do status nutricional e ao efeito das mudanças da configuração da parede torácica na capacidade da geração de força do músculo diafragma. A idade está também associada às mudanças imunológicas tanto na esfera pulmonar como sistêmica e muscular (sarcopenia).52
Deve ser ressaltado que a execução dos testes funcionais não é uma tarefa fácil nos pacientes com idade avançada, em decorrência dos distúrbios cognitivos e em certas ocasiões pela própria debilidade física. Nestes casos, pode-se lançar mão da impedância respiratória pela técnica de oscilação forçada.42 Os resultados por esta técnica se correlacionam com os índices espirométricos e com a medida da resistência das vias aéreas, medida através da pletismografia corporal.43
A correta interpretação das curvas espirométricas no paciente geriátrico não é tarefa fácil para o indivíduo não treinado. As mudanças fisiológicas no sistema respiratório devido ao envelhecimento podem confundir. Um dos maiores problemas são as tabelas que permitam a seleção do conjunto apropriado de valores de referência para evitar erros de classificação; em particular para valores dos limites inferiores, sendo o principal risco o de classificar os idosos saudáveis até como obstrutivos moderados.
Equações para o cálculo de valores de referência para espirometria para a faixa de 3 a 95 anos estão agora disponíveis, incluindo limites inferiores da normalidade, podendo ser aplicados às diferentes etnias globalmente.53-57
Diagnóstico Diferencial
Quanto ao diagnóstico diferencial, considerar: DPOC, doenças intersticiais pulmonares, bronquiectasias, doenças cardíacas, obstrução de vias aéreas superiores, carcinoma broncogênico, refluxo gastresofágico, aspiração etc. (Tabela 2).
Tabela 2— Diagnóstico Diferencial da Asma no Idoso
Doença Pulmonar Obstrutiva Crônica |
Insuficiência Cardíaca Congestiva |
Obstrução Respiratória Alta |
Bronquiectasias |
Embolia Pulmonar |
Refluxo Gastresofágico |
Carcinoma Broncogênico |
Doenças Reumáticas (LES, AR, Sjögren, ES) |
Vasculites (Churg-Strauss, Wegner) |
De todas as doenças a que mais cria dificuldades na diferenciação diagnóstica é a DPOC. Quando o início da asma ocorre, na idade adulta, em pacientes fumantes ou ex-fumantes a distinção nem sempre é clara. Nos países, onde a prevalência do tabagismo é elevada estima-se que um percentual ainda alto possa evoluir para a DPOC, e um número também significante para as duas condições associadas. Um fator importante é a atopia, pois a grande maioria dos asmáticos é atópica, apresentando por vezes outras doenças como a rinite alérgica e o eczema, devendo ser ressaltado, entretanto, que nem todo atópico apresenta asma.
Nesse contexto, alguns autores têm proposto a avaliação da atopia como uma ferramenta útil no diagnóstico diferencial entre asma e DPOC em idosos.58 A asma caracteriza-se pela hiper-responsividade brônquica que predispõe o paciente ao broncospasmo quando exposto a agentes desencadeantes como a inalação de poeira doméstica, polens, pêlos, substâncias excretadas por animais, irritantes etc. Os sintomas da asma variam de um dia para outro, o que não é comum na DPOC que se caracteriza principalmente pela dispneia durante o exercício.
As provas de função pulmonar contribuem para o diagnóstico e para distinguir uma doença da outra. Embora ambas sejam doenças obstrutivas, as provas funcionais podem ser normais nos asmáticos com asma leve. A obstrução na DPOC se deve primariamente à obstrução fixa das vias aéreas e ao consequente aumento na resistência das mesmas, sempre progressiva. A asma se caracteriza pela reversibilidade da obstrução ao uso de broncodilatadores, muitas vezes com resultados espetaculares, e possibilidade de normalização dos parâmetros, ao contrário da DPOC, que responde mal aos broncodilatadores e o seu VEF1 permanece sempre abaixo dos 75–80% do valor teórico. Os asmáticos no período intercrises podem apresentar provas funcionais respiratórias normais. O PFE na asma apresenta uma variabilidade > 20% no decurso do dia, o que não ocorre na DPOC. Quando as provas funcionais não forem capazes de estabelecer o diagnóstico, pode-se indicar o teste de broncoprovocação pela metacolina.
Quanto às doenças intersticiais pulmonares, os pacientes relatam dispneia aos esforços e raramente sibilos. Quando evoluem para fibrose, a ausculta pulmonar caracteriza-se por estertores inspiratórios grosseiros, principalmente nas bases. A espirometria, ao contrário da asma, evidencia uma síndrome restritiva. A tomografia computadorizada com cortes finos de alta resolução demonstra o infiltrado intersticial
e permite às vezes a possibilidade do diagnóstico etiológico.
Outra patologia que produz sibilância e em muitas ocasiões confunde-se com a asma, principalmente nas salas de emergência, é a Insuficiência Cardíaca Congestiva (ICC), em decorrência de falência ventricular esquerda. Tanto a asma como a ICC provocam dispneia, sibilos, ortopneia e opressão torácica. Sabe-se na atualidade que as vias aéreas na ICC também são hiper-responsivas, e talvez este seja outro fator com implicações na fisiopatologia da dispneia. Snashall e Chung59 avaliaram a obstrução brônquica em pacientes com ICC e estenose mitral através de testes de provocação com metacolina, acetilcolina e histamina, tendo obtido resultados consistentes que comprovavam a hiper-responsividade em 69% dos pacientes examinados. Embora em situações de emergência às vezes seja difícil o diagnóstico, o exame físico permite diagnosticar a ICC devido à turgência jugular, ausculta da 3ª ou 4ª bulhas cardíacas e a presença de edema de membros inferiores. Uma radiografia de tórax na maioria das vezes demonstra cardiomegalia e padrão de congestão vascular com inversão do fluxo. O ecodoppler cardíaco à beira do leito pode determinar muitas das vezes a etiologia da ICC. Deve ser salientado que frequentemente ocorre melhora da sintomatologia da insuficiência cardíaca após uso de broncodilatadores.
Várias condições que determinam obstrução de vias aéreas superiores configuram um grupo de doenças que pode se confundir com a asma, dentre elas os tumores, que são mais comuns nesta faixa etária, estenoses, pólipos, paralisia das cordas vocais, edema de laringe, epiglotite, malformações vasculares, amiloidose, granulomas, disfunção das cordas vocais etc. Pacientes com neoplasia de traqueia são geralmente tratados como asmáticos por longos períodos até que o diagnóstico correto seja efetuado.60-62 As metástases podem determinar obstrução e sibilância,61 sendo os tumores primários mais comuns os linfomas, os adenocarcinomas de mama e de cólon.
A embolia pulmonar, mais comum nos idosos, deve ser sempre considerada. O início é súbito com dor torácica, dispneia com sibilos e gasometria arterial semelhante à da asma. Os sintomas não melhoram com broncodilatador. Obesidade, passado recente de cirurgia, longa permanência no leito, hipercoagulabilidade associada ou não ao câncer, ICC e reposição hormonal com estrogênios constituem-se em fatores de risco para a embolia pulmonar.
Estima-se que a prevalência de Refluxo Ácido Gastresofagiano (RAGE) no idoso seja maior do que 20%. O RAGE no idoso pode ser a causa primária da tosse, sibilos e dispneia ou ser o responsável pelo agravamento de asma prévia. Pacientes com RAGE associado à asma, ou asma desencadeada por RAGE manifestam os mesmos sintomas, porém 25-30% se apresentam com refluxo gastresofágico silencioso ou assintomático.63 Kennedy64 em 1962 pela primeira vez relatou esta associação entre refluxo gastresofagiano silencioso e asma.
Estudos em animais e humanos estabeleceram pelo menos três mecanismos que podem determinar a asma induzida pelo RAGE:
1. Tono vagal exacerbado, decorrente da estimulação dos receptores do esôfago inferior pelo refluxo ácido65
2. Intensificação da hiper-responsividade brônquica
3. Microaspiração de ácido, determinando broncoconstrição e edema da mucosa.66,67
O câncer de pulmão é uma doença com maior incidência no idoso. Raramente ocorre antes dos 40 anos. A média de idade do diagnóstico ocorre entre os 60–70 anos, com mais da metade dos casos incidindo em pessoas de 65 a 75 anos.67 Nos Estados Unidos, entre 1985 e 1995, a proporção de casos de câncer de pulmão em pacientes com ≥ 70 anos aumentou de 35 para 43%.68 Em 2020 estavam previstos 228.820 casos de câncer de pulmão.69 O câncer de pulmão pode se manifestar clinicamente através de dispneia e sibilos. A dispneia é determinada pela obstrução da luz brônquica que produz alterações da relação ventilação-perfusão. Os sibilos à ausculta pulmonar comumente são localizados, ao contrário da asma quando são difusamente distribuídos.
As manifestações pulmonares das doenças reumáticas podem em muitas circunstâncias mascarar a asma. A artrite reumatoide (AR), talvez a mais importante das doenças reumáticas no idoso, acometendo 1% da população geral, é uma doença sistêmica com proeminente manifestação pleuropulmonar. Embora sua incidência seja maior no sexo feminino, as manifestações pulmonares são mais frequentes nos homens. A obstrução crônica das vias aéreas é um achado comum na AR.70-73 Em um estudo, Geddes et al.70 compararam um grupo de cem pacientes com AR e radiografias de tórax normais, com um grupo controle de 84 indivíduos com parâmetros semelhantes para idade, sexo e hábito tabágico. Os índices espirométricos de obstrução (VEF1, VEF1 /CVF e FEF25-75% ) foram significativamente menores no grupo com AR, com prevalência para obstrução no grupo com AR de 38%. Em um outro estudo, avaliando uma série de cem pacientes com AR, a prevalência de obstrução brônquica (definida como redução no VEF1, VEF1 /CVF e FEF25-75% ou FEF25-75% /CVF) em 81 pacientes não fumantes foi de 16%.73 Hassan et al. demonstraram um aumento da hiper-responsividade brônquica em pacientes com AR.71 Nesta série, 55% dos pacientes com AR apresentavam responsividade à metacolina, quando comparados a 16% do grupo controle. Além disso, 18% dos pacientes referiam história consistente para obstrução, com sibilos.
A manifestação brônquica da Síndrome de Sjögren é determinada por patologia glandular e extraglandular. A insuficiência glandular determina dissecação traqueobrônquica74-76 e a extraglandular uma infiltração linfocítica das vias aéreas, com aspecto histopatológico de bronquiolite folicular, produzindo sintomas e sinais de doença obstrutiva brônquica. Hiper-responsividade também foi relatada nestes pacientes.77,78 Na aplicação do teste de provocação à metacolina, aproximadamente 50% dos pacientes com Síndrome de Sjögren primária ou secundária (associada à esclerose sistêmica)77,78 apresentavam hiper-responsividade, quando comparados a 6,5% dos controles.78
A esclerodermia, doença menos comum, se apresenta em 25% dos casos com início após os 60 anos, em sua forma clínica difusa. A maioria dos pacientes apresenta distúrbio da motilidade esofágica, com dilatação, o que favorece a pneumonites de aspiração. Aproximadamente 70% dos pacientes apresentam evidência de doença intersticial, que evolui para fibrose, e doença vascular, com hipertensão arterial pulmonar. A dispneia aos esforços é o sintoma mais comum, ocorrendo em 60% (variando de 21% a 88%) dos pacientes,79-82 enquanto que 11–18%82,83 apresentam tosse seca, não produtiva, mais comum nos fumantes. Sibilos ocorrem em cerca de 19% dos casos, independente do hábito tabágico.83 A distinção da asma através das provas de função respiratória pode ser difícil, embora na esclerodermia em sua forma difusa, exista predomínio restritivo em 30-60% dos casos. A tomografia computadorizada com cortes finos de alta resolução demonstra o infiltrado intersticial, permitindo muitas vezes a possibilidade do diagnóstico etiológico.
Na pessoa idosa, a broncoaspiração pode causar ou exacerbar a tosse e a dispneia, sintomas da asma. Os fatores que contribuem para a aspiração no velho são a diminuição do reflexo do vômito, alterações no estado mental determinado por sedantes, álcool e doenças neuropsiquiátricas.
Comorbidades
A asma dos jovens difere daquela dos idosos, também pela associação de inúmeras comorbidades que podem influenciar desde o próprio diagnóstico, mais difícil como já relatado, como inclusive na condução terapêutica, pois os adultos mais velhos são mais vulneráveis a eventos adversos de polifarmácia, e isso deve ser levado em consideração ao selecionar o tratamento adequado para asma.84
Na prática, todas as comorbidades devem ser tratadas, pois, por exemplo, o estresse decorrente como parte da depressão, ansiedade e mudanças de humor, que têm um impacto físico no corpo, tendem a gerar problemas agravando a asma.85
Existe um risco aumentado de fibrilação atrial em pacientes com asma tratados com broncodilatadores.86 Essa observação merece atenção na prática clínica baseada no uso crônico de broncodilatadores que podem desencadear arritmias. Certamente, a coexistência de distúrbios cardiovasculares prévios também aumenta a frequência e a gravidade dos efeitos colaterais.87
Exacerbação da Asma no Idoso
Os pacientes com asma são mais susceptíveis a infecções virais respiratórias do que os não asmáticos, apresentando uma resposta nitidamente mais forte.88 Estudos epidemiológicos prospectivos evidenciam que 80% das exacerbações de asma em crianças em idade escolar e 50% de todas as exacerbações em adultos estavam associadas às infecções virais do trato respiratório superior, sendo o rinovírus humano considerado como o principal vírus associado às exacerbações em asmáticos.89 Existem poucas dúvidas de que a maioria dos vírus (adenovírus, influenza, vírus sincicial respiratório, parainfluenza) infecta o trato respiratório baixo.90 Existem evidências muito claras de que isto ocorra também com os rinovírus. Pattemore91 detectou vírus em secreções brônquicas em mais de 40% das exacerbações de asma em crianças e em mais de 20% das exacerbações em adultos.
As complicações decorrentes das exacerbações da asma desencadeadas por vírus em idosos são sempre mais intensas do que nas outras faixas etárias, causando agravamento da asma por até várias semanas, fato decorrente da maior debilidade inerente à idade e possíveis comorbidades associadas, principalmente cardiopulmonares.
No que concerne aos idosos além do rinovírus, principal agente imputado nas exacerbações da asma, deve ser salientada as infecções pelo vírus influenza A (não panendêmica) e pelo Vírus Sincicial Respiratório (VSR). A infecção pelo VSR determina importante doença nesta faixa etária, semelhante a da influenza. A infecção pelo VSR tem sido reconhecida como complicante em pacientes idosos, principalmente naqueles com alto risco, incluindo-se os pacientes com asma. Thompson et al. estimaram que o VSR é o responsável por aproximadamente 10.000 mortes anualmente nos Estados Unidos, em pessoas acima de 65 anos.92 A infecção por RSV pode resultar em maior morbidade e mortalidade entre adultos hospitalizados mais velhos do que a influenza.
Publicação de Falsey et al.93 relata o acompanhamento durante quatro invernos consecutivos de três grupos de uma população ≥ 65 anos, um grupo de alto risco cardiopulmonar, um de pacientes internados devido a condições cardiopulmonares agudas e um grupo controle. Avaliaram infecções pelos vírus sincial respiratório e influenza A, através de cultura, RT-PCR (Reverse Transcription-Polymerase Chain Reaction) e estudos sorológicos. Concluíram que a infecção pelo VSR era a responsável por 10,6% de hospitalizações por pneumonia, 11,4% devido à DPOC, 5,4% à ICC e 7,2% devido à asma.
Recentemente a Anvisa aprovou a primeira vacina para prevenção da infecção pelo vírus sincicial respiratório (VSR) causador da bronquiolite. Está indicada, em dose única, para imunização ativa para a prevenção da doença respiratória inferior, causada pelos subtipos VSR-A e VSR-B em adultos com 60 anos de idade.94 Objetivando uma eficácia semelhante à da vacinação contra o vírus influenza A, que reduz a taxa de hospitalização em 40–50%95,96 com consequente redução da mortalidade, a vacina indicada para prevenção do VSR forneceu proteção em todo o espectro clínico da doença, desde infecção leve do trato respiratório superior até doença grave do trato respiratório inferior. Adultos mais velhos, particularmente aqueles com condições coexistentes como asma e DPOC, e que correm maior risco de doença grave por VSR, agora podem se beneficiar de uma vacina eficaz.97
➢Tratamento da Asma :: Situações Específicas - Tratamento da Asma no Idoso
Referências
01.WHO – World Health Organization - Ageing.
Disponível em: https://www.who.int/health-topics/ageing#tab=tab_1. Acesso em: 25 de junho de 2021.
02.IBGE. Censo Demográfico 2022: Características da População e dos Domicílios. Rio de Janeiro: IBGE, 2023. Disponível em: https://basedosdados.org/dataset/08a1546e-251f-4546-9fe0-b1e6ab2b203d?raw_data_source=398bc66b-babd-40ba-935a-6fb6ea6453ba
03.Gov.br SECOM – Censo: número de idosos no Brasil cresceu 57,4% em 12 anos. Disponível em: https://www.gov.br/secom/pt-br/assuntos/noticias/2023/10/censo-2022-numero-de-idosos-na-populacao-do-pais-cresceu-57-4-em-12-anos
04.Population Pyramids – Japan 2024. Disponível em: https://population-pyramid.net/en/pp/japan
05.Parameswaran K, Hildreth AJ, Chadha D, Keaney NP, Taylor IK, Bansal SK: Asthma in the elderly: underperceived, underdiagnosed and undertreated; a community survey. Respir Med 1998; 92:573-577.
06.Dickinson JA, Meaker M, Searle M, Ratcliffe G: Screening older patients for obstructive airways disease in a semi-rural practice. Thorax 1999; 54:501-505.
07.Kotaniemi JT, Lundback B, Nieminen MM, Sovijarvi AR, Laitinen LA: Increase of asthma in adults in northern Finland? - a report from the FinEsS study. Allergy 2001; 56:169-174.
08.Kim YK, Kim SH, Tak YJ, Jee YK, Lee BJ, Park HW, Jung JW, Bahn JW, Chang YS, Choi DC: High prevalence of current asthma and active smoking effect among the elderly. Clin Exp Allergy 2002; 32:1706-1712.
09.Arif AA, Rohrer JE, Delclos GL: A population-based study of asthma, quality of life, and occupation among elderly Hispanic and non-Hispanic whites: a cross-sectional investigation. BMC Public Health. 2005; 5: 97-10.1186/1471-2458-5-97.
10.Moorman JE, Rudd RA, Johnson CA, King M, Minor P, Bailey C, Scalia MR, Akinbami LJ: National surveillance for asthma--United States, 1980–2004: Department of Health and Human Services, Centers for Disease Control and Prevention, 2007.
11.Oraka E, Kim HJ, King ME, et al. Asthma prevalence among US elderly by age groups: age still matters. J Asthma 2012; 49: 593-599.
12.
Australian Bureau of Statistics – Asthma - Disponível em: https://www.abs.gov.au/statistics/health/health-conditions-and-risks/asthma/latest-release#data-download. Acesso em: 20 de março de 2019.
13.Pennington E, Yaqoob ZJ, Al-Kindi SG, Zein J. Trends in Asthma Mortality in the United States: 1999 to 2015. Am J Respir Crit Care Med 2019; 199:1575-1577.
14.Orie NGM, Sluiter ID, De Vries K, Tammeling GJ, Witkop J. — The host factor in bronchitis. In: Orie NGM, Sluiter HJ, eds. Bronchitis. Assen, Netherlands: Royal Van Gorcum; 1961:43-59.
15.Fabbri LM, Romagnoli M, Corbetta L. Differences in airway inflammation in patients with fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2003; 167:418-24.
16.Alshabanat A, Albanyan O, Dairi M, FitzGerald JM. Asthma and COPD overlap syndrome (ACOS). A systematic review and meta analysis. PLos One 2015; 10:e0136065.
17.Gibson PG, Simpson JL. The overlap syndrome of asthma and COPD: what are its features and how importante is it? Thorax 2009; 64:728-35.
18.Kauppi P, Kupiainen H, Lindqvist A, Tammilehto L, Kilpelainen M, Kinnula VL, Haahtela T, et al. Overlap syndrome of asthma and COPD predicts low quality of life. J Asthma 2011; 48:279-85.
19.Kendzerska T, Sadatsafavi M, Aaron SD, To TM, Lougheed MD, FitzGerald JM, Gershon AS. Concurrent physician-diagnosed asthma and chronic obstructive pulmonary disease: A population study of prevalence, incidence and motality. PLos One 2017; 12:e0173830.
20.Andersen H, Lampela P, Nevanlinna A, Saynajakangas O, Keistinen T. High hospital burden in overlap syndrome of asthma and COPD. Clin Respir J 2013; 7:342-6.
21.Broder I, Barlow PP, Horton RJM. The epidemiology of asthma and hay fever in a total community, Tecumseh, Michigan: I. Description of study and general findings. J Allergy 1962; 33:513-523.
22.Burr ML, Charles TJ, Roy K, Seaton A. Asthma in the elderly: an epidemiological survey. Br Med J 1979; 1:1041-1044.
23.Derrick EH. The significance of the age of onset of asthma. Med J Aust 1971; 1:1317-1319.
24.Lee HY, Stretton TB. Asthma in the elderly. Br Med J 1972; 4:93-95.
25.Gibson PG, McDonald VM, Marks GB. Asthma in older adults. Lancet 2010; 376: 803–813.
26.Zein JG, Dweik RA, Comhair SA, Bleecker ER, Moore WC, Peters SP, et al. Asthma Is More Severe in Older Adults. PLoS ONE 2015; 10(7): e0133490. https://doi.org/10.1371/journal.pone.0133490.
27.Hanania NA, King MJ, Braman SS, Saltoun C, Wise RA, Enright P, Falsey AR, Mathur SK, Ramsdell JW, Rogers L, et al.; Asthma in Elderly workshop participants. Asthma in the elderly: current understanding and future research needs–a report of a National Institute on Aging (NIA) workshop. J Allergy Clin Immunol 2011;128: S4–S24.
28.Janssens JP, Pache JC, Nicod LP. Physiological changes in respiratory function associated with ageing. Eur Respir J 1999; 13(1):197–205.
29.Niewoehner DE, Kleinerman J. Morphologic basis of pulmonary resistance in the human lung and effects of aging. J Appl Physiol 1974; 36:412–8.
30.Milic-Emili J, Torchio R, D'Angelo E. Closing volume: a reappraisal (1967–2007). Eur J Appl Physiol 2007; 99:567–83.
31.Anthonisen NR, Danson J, Robertson PC, Ross WR. Airway closure as a function of age. Respiration physiology 1969; 8(58–65.
32.Verbeken EK, Cauberghs M, Mertens I, Clement J, Lauweryns JM, Van de Woestijne KP. The senile lung. Comparison with normal and emphysematous lungs. 1. Structural aspects. Chest 1992; 101:793–9.
33.Hochhegger B, Meirelles GS, Irion K, Zanetti G, Garcia E, Moreira J, Marchiori E. The chest and aging: radiological findings. J Bras Pneumol 2012;38:656–665.
34.Janssens JP, Pache JC, Nicod LP. Physiological changes in respiratory function associated with ageing. Eur Respir J 1999;13:197–205.
35.Sorino C, Battaglia S, Scichilone N, Pedone C, Antonelli-Incalzi R, Sherrill D, Bellia V.Diagnosis of airway obstruction in the elderly: contribution of the SARA study. Int J Chron Obstruct Pulmon Dis 2012;7:389–395.
36. Janssens JP. Aging of the respiratory system: impact on pulmonary function tests and adaptation to exertion. Clin Chest Med 2005;26:469–484, vi–vii.
37.Skloot GS, Busse PJ, Braman SS, Kovacs EJ, Dixon AE, Fragoso CAV, Scichilone N, Prakash YS, Pabelick CM, Mathur SK, Hannania NA, Moore WC, Gibson PG, Zieman S, Ragless B. An Official American Thoracic Society Workshop Report: Evaluation and Management of Asthma in the Elderly. Ann Am Thorac Soc 2016; 13: 2064-2077.
38.de Nijs SB, Venekamp LN, Bel EH. Adult-onset asthma: is it really different? Eur Respir Rev 2013; 22:44-52.
39.Nicholson KG, Kent J, Hammersley V et al. Risk factors for lower respiratory complications of rhinovirus infections for elderly people living in the community: prospective cohort study. BMJ 1996; 313:1119.
40.Burney PG, Britton JR, Chinn S et al. Descriptive epidemiology of bronchial reactivity in an adult population: results from a community study. Thorax 1987; 42:38-44.
41.Derrick EH. The significance of the age of onset of asthma. Med J Aust 1971; 1:1317-1319.
42.Corvalhaes-Neto N, Lorino H, Gallinari C et al. Cognitive function and assessment of lung function in the elderly. Am J Respir Care Med 1995; 152:1611-1615.
43.Chalker RB, Cell RR. Special considerations in the elderly patients. Clin Chest Med 1993; 14 (3):437-452.
44.McConnell WD, Holgate ST. – The Definition of Asthma: Its Realationship to Other Chronic Obstructive Lung Diseases. In: T.J.H. Clark, S. Godfrey, T,H. Lee, N.C. Thomson. Asthma . 4th edition. London: Arnold; 2000:1-31.
45.Prince DS, Carliner NH. Respiratory arrest following first dose of timolol ophtalmic solution. Chest 1983; 84:640-641.
46.Braman SS. Asthma in the elderly patient. Clin Chest Med 1993; 14 (3):413-422.
47.Allen SC, Baxter M. A comparison of four tests of cognition as predictors of inability to perform spirometry in old age. Age Ageing 2009; 38: 537-541.
48.Allen SC, Yeung P. Inability to draw intersecting pentagons as a predictor of unsatisfactory spirometry technique in elderly hospital inpatients. Age Ageing 2006; 35: 304-306.
49.Sorino C, Sherrill D, Guerra S, et al. Prognostic value of FEV1/FEV6 in elderly people. Clin Physiol Funct Imaging 2011; 31: 101–107.
50.Jamison JP, McKinley RK. Validity of peak expiratory flow rate variability for diagnosis of asthma. Clin Sci 1993; 85:367-71.
51.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention uptdated 2021. Disponível em: https://ginasthma.org/wp-content/uploads/2021/05/GINA-Main-Report-2021-V2-WMS.pdf . Acesso em: 28 de maio de 2021.
52.Benz E, Trajanoska K, Schoufour JD, Lahousse L, de Roos EW, Terzikhan N, Medina-Gomez C, Verhamme K, Williams R et. Sarcopenia in older people with chronic airway diseases: the Rotterdam study. ERJ Open Research 2021 7:00522-2020.
53.Quanjer PH, Stanojevic S, Cole TJ, et al. Multi-ethnic reference values for spirometry for the 3-95-yr age range: the global lung function 2012 equations. Eur Respir J 2012; 40: 1324-1343.
54.Pistelli R, Bellia V, Catalano F, et al. Spirometry reference values for women and men aged 65–85 living in southern Europe: the effect of health outcomes. Respiration 2003; 70: 484-489.
55.Garcia-Rio F, Dorgham A, Pino JM, et al. Lung volume reference values for women and men 65 to 85 years of age. Am J Respir Crit Care Med 2009; 180: 1083-1091.
56.Loth DW, Ittermann T, Lahousse L, et al. Normal spirometry values in healthy elderly: the Rotterdam Study. Eur J Epidemiol 2013; 28: 329-334.
57.Karrasch S, Flexeder C, Behr J, et al. Spirometric reference values for advanced age from a South German population. Respiration 2013; 85: 210-219.
58.Sin BA, Akkoca O, Saryal S, et al. Differences between asthma and COPD in the elderly. J Investig Allergol Clin Immunol 2006; 16: 44-50.
59.Snashall PD, Chung KF. Airway obstruction and bronchial hiperresponsiveness in left ventricular failure and mitral stenosis. Am Rev Respir Dis 1991; 144:945.
60.Houston HW, Payne WS, Harrison EG Jr, et al. Primary cancers of trachea. Arch Surg 1969; 99:132-40.
61.Garces M, Tsai E, Marsan RE. Endotracheal metastasis. Chest 1974; 65:350-51.
62.Hakami M, Pai RP, Fine G et al. Fibrous histocytoma of trachea. Chest 1975; 68 :367-68.
63.Simpson WG. Gastroesophageal reflux disease and asthma: diagnosis and management. Arch Intern Med 1995; 155:798-803.
64.Kennedy JH. Silent gastroesophageal reflux: an important but little known course of pulmonary complications. Dis Chest 1962; 42:42-45.
65.Mansfield LE, Stein MR. Gastroesophageal reflux and asthma: a possible reflex mechanism. Ann Allergy 1978; 41:224-226.
66.Moote DW, Lloyd DA, McCourtie DR, et al. Increase in gastroesophageal reflux during methacholine-induced bronchospasm. J Allergy Clin Immunol 1986; 78:619-23.
67.Bilello KS, Murin S, Matthay RA. Epidemiology, etiology, and prevention of lung cancer. Clin Chest Med 2002; 23 (1):1-25.
68.Stewart AK, Bland KI, McGinnis LS Jr. Clinical highlights from the National Cancer Data Base: 2000. CA Cancer J Clin 2000; 50:171-183.
69.American Cancer Society. Cancer Statistics Center. 2020 Estimates. Disponível na internet. URL: https://cancerstatisticscenter.cancer.org/?_ga=2.49966755.46679880.1590684174-1382401691.1590684174#!/ Acesso em: 27 de maio de 2020.
70.Geddes DM, Webley M, Emerson PA. Airways obstruction in rheumatoid arthritis. Ann Rheum Dis 1979; 38:222-225.
71.Hassan WU, Keaney NP, Holland CD et al. Bronchial reactivity and airflow obstruction in rheumatoid arthritis. Ann Rheum Dis 1994; 53:511-514.
72.Mountz JD, Turner RA, Collins RL et al. Rheumatoid arthritis and small airways function. Arthritis Rheum 1984; 27:728-736.
73.Radoux V, Menard HA, Begin R et al. Airways disease in rheumatoid arthritis patients. Arthritis Rheum 1987; 30:249-256.
74.Constantopoulos SH, Papadimitriou CS, Moutsopoulos HM. Respiratory manifestations in primary Sjögren's syndrome. Chest 1985; 88:226-229.
75.Lahdensuo A, Korpela M. Pulmonary findings in patients with primary Sjögren's syndrome. Chest 1995; 108:316-319.
76.Papathananasiou MP, Constantopoulos SH, Tsampoulas C et al. Reappraisal of respiratory abdormalities in primary and secondary Sjögren syndrome. A controlled study. Chest 1986; 90:370-374.
77.Gudbjornsson B, Hedenstrom H, Stalenheim G et al. Bronchial hyperresponsiveness to metacholine in patients with primary Sjögren's syndrome. Ann Rheum 1991; 50:36-40.
78.La Corte R, Bajocchi G, Potena A et al. Bronchial hyperreactivity in systemic sclerosis patients: influence of associated Sjögren syndrome. Ann Rheum Dis 1995; 54:636-639.
79.Bridges AJ, Hsu K-C, Dias-Arias AA et al. Bronchiolitis obliterans organizing pneumonia and scleroderma. J Rheumatol 1992; 19:1136-1140.
80.Owens GR, Follansbee WP. Cardiopulmonary manifestations of systemic sclerosis. Chest 1987; 91:118-127.
81.Steen VD, Owens GR, Fino et al. Pulmonary involvement in systemic sclerosis (scleroderma). Arthritis Rheum 1985; 28:759-767.
82.Bjerke RD, Tashkin DP, Clements PJ et al. Small airways in progressive systemic sclerosis. Am J Med 1979; 66:201-209.
83.Greenwald GI, Tashkin DP, Gong H et al. Longitudinal changes in lung function and respiratory symptoms in progressive systemic sclerosis. Am J Med 1987; 83:8.
84. Battaglia S, Benfante A, Spatafora M, Scicgilone N. Asthma in the elderly: a diferente disease? Breathe 2016 12:18-28.
85.Bellia V, Pedone C, Catalano F, et al. Asthma in the elderly: mortality rate and associated risk factors for mortality. Chest 2007; 132: 1175-1182.
86.Chan WL, Yang KP, Chao TF, et al. The association of asthma and atrial fibrillation – a nationwide population-based nested case-control study. Int J Cardiol 2014; 176: 464-469.
87.Pfeifer MA, Weinberg CR, Cook D, et al. Differential changes of autonomic nervous system function with age in man. Am J Med 1983; 75:249-258.
88.Bardin PG, Fraenkel D, Sanderson G et al. Increased sensitivity to the consequences of rhinoviral infection in atopic subjects. Chest 1995; 107(Suppl.3):157S.
89.Micillo E, Marcatili P, Palmieri S, Mazzarella G. Viruses and asthmatic syndromes. Monaldi Arch Chest Dis 1998; 53:88.
90.Johnston SL. Natural and experimental infection of lower respiratory tract. Am J Respir Crit Care Med 1995; 152:46.
91.Pattemore PK, Johnston SL, Bardin PG. Viruses as precipitants of asthma symptoms. I. Epidemiology. Clin Exp Allergy 1992; 22:325.
92.Thompson WW, Shay DK, Weintraub E, et al. Mortality associated with influenza and respiratory syncicytial virus in the United States. JAMA 2003; 289:179.
93.Falsey AR, Patricia A, Hennessey PA, Formica MA, Cox C., Walsh EE. Respiratory syncytial virus infection in elderly and high-risk adults. N Engl J Med 2005; 352:17.
94.Brasil. Ministério da Saúde. Anvisa aprova registro da primeira vacina para bronquiolite. Disponível em:https://www.gov.br/anvisa/pt-br/assuntos/noticias-anvisa/2023/anvisa-aprova-registro-de-primeira-vacina-para-bronquiolite Acesso em: 27 de setembro de 2024.
95.Nichol KL, Margolis KL, Wuorenma J, Von Sternberg T. The efficacy and cost effectiveness of vaccination against influenza among elderly persons living in the community. N Engl J Med 1994; 331:778.
96.Simões,CC da S. Relações entre as Alterações Históricas na Dinâmica Demográfica Brasileira e os Impactos Decorrentes do Processo de Envelhecimento da População. Rio de Janeiro:IBGE, 2016.116p. Disponível na internet: http://biblioteca.ibge.gov.br/visualizacao/livros/liv98579.pdf Acesso em: 24/07/2017.
97.Papi A, Ison MG, Langley JM, Lee DG, Leroux-Roels I, Martinon-Torres F, Schwarz TF, van Zyl-Smit RN, Campora L, Dezutter N, de Schrevel N, Fissette L, David MP, Van der Wielen M, Kostanyan L, Hulstrøm V; AReSVi-006 Study Group. Respiratory Syncytial Virus Prefusion F Protein Vaccine in Older Adults. N Engl J Med 2023; 388:595-608.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|