|
Asma
ASMA NA INFÂNCIA
A asma pediátrica é um sério problema de saúde pública em todo o mundo, estimando-se que nos EUA existiam em 2020 mais de 4,6 milhões de crianças menores de 18 anos acometidas pela doença (prevalência de 6,5%), ou seja, estima-se que para cada 12 crianças em idade escolar 1 é acometida pela asma.1 Em 2020, na mesma faixa etária, ocorreram 270.330 atendimentos na emergência com 27,055 internações hospitalares.1 A prevalência da asma pediátrica na União Europeia é de 9,4%, acometendo na atualidade cerca de 5,5 milhões de crianças.2 Em todo o mundo, a maior prevalência de asma ocorre no Reino Unido, Nova Zelândia, Austrália, Irlanda, Canadá e EUA.
O Reino Unido apresenta uma das mais altas prevalências de asma infantil na Europa, cerca de 1 milhão de crianças recebendo tratamento para asma, além de registrar taxas elevadas de admissões de emergência e mortalidade relacionadas à doença.3
Apesar da dificuldade para se diagnosticar a asma em crianças de tenra idade, existem evidências de que a metade de todos os casos de asma na infância são diagnosticados até os 3 anos de idade e 80% de todos os casos de asma até os 6 anos, sendo que em 1/3 os primeiros sintomas começam antes de completarem um ano de vida.4 Nas crianças há predomínio do sexo masculino, variando entre 3:2 a 2:1. Esta supremacia está relacionada à possível maior produção de IgE e ao maior tônus das vias aéreas, que também são mais estreitas nos meninos. O índice passa a 1:1 entre os 10 e 12 anos, uma vez que a relação diâmetro/comprimento passa a ser a mesma para ambos os sexos, quando ocorrem mudanças no tamanho do tórax em meninos, o que não acontece com as meninas. Na idade adulta passa a ocorrer predomínio do sexo feminino.
 Globalmente a frequência da asma declarada dobrou nos últimos trinta anos, em parte pelo aumento real do número de casos, como pelo melhor reconhecimento da doença pela comunidade médica. A dificuldade de se comparar os dados epidemiológicos de um país com outro, e às vezes de uma região para outra, motivou a realização de uma grande pesquisa internacional, o estudo ISAAC – International Study of Asthma and Allergies in Childhood.5 Em sua primeira fase, através de um questionário simples, estandardizado e validado, com poucas perguntas, autoaplicável, este estudo avaliou 304.796 crianças de 42 países, entre 6–7 anos de idade e 463.801 adolescentes em 155 centros de 56 países entre 13–14 anos. A enquete permitiu distinguir três grupos de países segundo as taxas de prevalência da asma: fraca (inferior a 5%), média (5–6%) e forte (superior a 10%). As maiores prevalências foram registradas nos países anglo-saxões: Inglaterra, Nova Zelândia, Austrália, Irlanda, Canadá, Estados Unidos onde a prevalência encontrada ≥ 20%, enquanto que as mais baixas ocorreram nos países do leste europeu, Indonésia, Grécia, Taiwan, Índia e Etiópia. Neste estudo multicêntrico o Brasil ficou classificado em 8º lugar, com prevalência média de 20%. Participaram da fase inicial do estudo ISAAC pesquisadores brasileiros das cidades de Curitiba, Itabira, Porto Alegre, Recife, Salvador, São Paulo e Uberlândia. Globalmente a frequência da asma declarada dobrou nos últimos trinta anos, em parte pelo aumento real do número de casos, como pelo melhor reconhecimento da doença pela comunidade médica. A dificuldade de se comparar os dados epidemiológicos de um país com outro, e às vezes de uma região para outra, motivou a realização de uma grande pesquisa internacional, o estudo ISAAC – International Study of Asthma and Allergies in Childhood.5 Em sua primeira fase, através de um questionário simples, estandardizado e validado, com poucas perguntas, autoaplicável, este estudo avaliou 304.796 crianças de 42 países, entre 6–7 anos de idade e 463.801 adolescentes em 155 centros de 56 países entre 13–14 anos. A enquete permitiu distinguir três grupos de países segundo as taxas de prevalência da asma: fraca (inferior a 5%), média (5–6%) e forte (superior a 10%). As maiores prevalências foram registradas nos países anglo-saxões: Inglaterra, Nova Zelândia, Austrália, Irlanda, Canadá, Estados Unidos onde a prevalência encontrada ≥ 20%, enquanto que as mais baixas ocorreram nos países do leste europeu, Indonésia, Grécia, Taiwan, Índia e Etiópia. Neste estudo multicêntrico o Brasil ficou classificado em 8º lugar, com prevalência média de 20%. Participaram da fase inicial do estudo ISAAC pesquisadores brasileiros das cidades de Curitiba, Itabira, Porto Alegre, Recife, Salvador, São Paulo e Uberlândia.
A Fase I do The Global Asthma Network (GAN), realizada entre 2015 e 2020, avaliou a prevalência de sintomas de asma através de questionários, seguindo o mesmo protocolo padronizado utilizado nas Fases I (1992–1995) e III (2000–2003) da pesquisa ISAAC. Participaram do estudo alunos de escolas com idades entre 13 e 14 anos (adolescentes) (Figura 1) e, opcionalmente, crianças de 6 a 7 anos, selecionados por amostragem em centros específicos dentro de uma área geográfica. Além disso, no estudo GAN, houve a possibilidade de incluir os pais ou responsáveis dos adolescentes e/ou crianças como um grupo de adultos. De um modo geral a prevalência da asma/sibilos em crianças se manteve relativamente estável entre as Fases I e III do ISAAC e a Fase I do estudo GAN.6
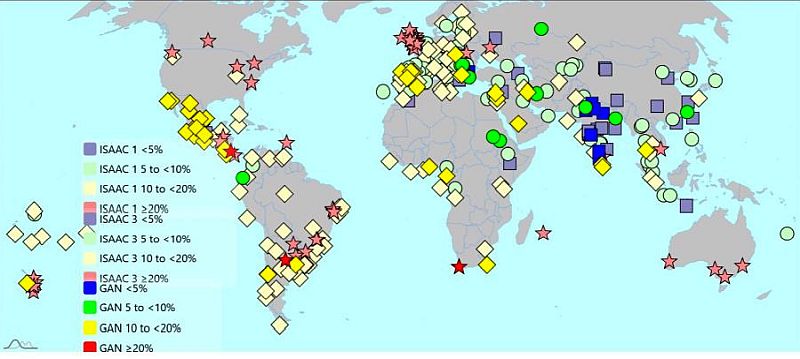
Figura 1 – Global Asthma Report (GAN) – 2022 – Prevalência de sintomas atuais de asma em adolescentes de 13 a 14 anos. De um modo geral a prevalência de sibilos em crianças e adolescentes se manteve relativamente estável entre a Fase I (1992–1995) e III (2000–2003) do ISAAC e a Fase I do GAN 2022, embora alguns centros individuais tenham relatado alterações substanciais.
Fatores de Risco
Pesquisas sugerem vários fatores que podem contribuir para o aumento da asma infantil. Dentre eles, a dieta, a poluição, o status socioeconômico, o local da residência, o aumento da sobrevivência de fetos prematuros com os pulmões não totalmente desenvolvidos.
Entretanto, a
atopia é o principal fator de risco para asma infantil, caracterizada pela predisposição genética para a produção de anticorpos específicos da imunoglobulina E (IgE) e pelo desenvolvimento de reações imediatas de hipersensibilidade a antígenos ambientais comuns. Aproximadamente um terço das crianças com atopia desenvolverá asma em etapas posteriores da vida.7,8
O aumento do número de mulheres grávidas fumantes eleva a probabilidade de baixo peso e capacidade pulmonar reduzida no recém-nascido.9 Além disso é bem conhecido o fato de que a exposição à fumaça do cigarro in utero é capaz de alterar o crescimento das vias aéreas e pulmões do feto, o que aumenta tanto a resistência como o risco de sibilância nas fases mais precoces da vida.
Uma metanálise concluiu que o tabagismo pré-natal teve seu efeito mais forte em crianças pequenas, enquanto o tabagismo materno pós-natal pareceu relevante apenas para o desenvolvimento da asma em crianças mais velhas.10
Na atualidade acredita-se que a exposição à fumaça do tabaco possa prejudicar a saúde das pessoas até após duas gerações através do “efeito transgeracional” ou “intergeracional”. Isto pôde ser constatado após estudo de Liu et al.11 analisando 1689 pares de pais e filhos, quando constataram que as crianças são muito mais propensas a desenvolver asma (59%) se os pais foram expostos ao fumo passivo na infância, quando comparados a crianças cujos pais não tiveram exposição.
Estudos transversais mostraram que os cigarros eletrônicos, introduzidos no mercado no início dos anos 2000, aumentam o risco de asma tanto em adolescentes quanto em adultos.12
Estudos de metanálise demonstraram que a obesidade é importante fator para o desenvolvimento de asma.13-15 Crianças obesas têm risco > 50% maior de desenvolver asma do que crianças com peso normal.16,17 Além disso, há uma relação linear entre o risco de asma infantil e o aumento no IMC materno pré-gestacional.18 Hoje sabemos que prevenir a obesidade desde cedo é fundamental, pois crianças com obesidade têm maior probabilidade de se tornarem adultos obesos.
O uso de antibióticos durante a gravidez e em bebês e crianças pequenas tem sido associado ao desenvolvimento de asma mais tarde na vida, embora nem todos os estudos tenham mostrado essa associação.19-22 Tem sido proposto que a exposição a antibióticos no período pré-natal comprometa as bactérias protetoras do microbioma, o que pode alterar a interface microbiana-mucosa normal e promover o desenvolvimento de asma.23,24 A incidência de asma infantil está diminuindo em algumas partes da Europa e América do Norte, sendo que a partir de um grande estudo populacional no Canadá, os pesquisadores conseguiram demonstrar uma correlação com um declínio na incidência de asma e grandes reduções na prescrição de antibióticos durante a infância.19
Estudos observacionais identificaram um aumento de 30% ou mais no risco de asma em crianças e  adolescentes que usaram paracetamol – um analgésico antipirético amplamente utilizado – no ano anterior ou durante o primeiro ano de vida.25-28 De forma semelhante, a utilização de paracetamol durante a gestação foi associada a um aumento de 20% a 50% no risco de asma e sibilância nos filhos.26 Mais recentemente, a presença de metabólitos de acetaminofen no sangue do cordão umbilical foi associado, em análise multivariada, a aumento nas chances de asma em crianças após seis anos de acompanhamento.28 adolescentes que usaram paracetamol – um analgésico antipirético amplamente utilizado – no ano anterior ou durante o primeiro ano de vida.25-28 De forma semelhante, a utilização de paracetamol durante a gestação foi associada a um aumento de 20% a 50% no risco de asma e sibilância nos filhos.26 Mais recentemente, a presença de metabólitos de acetaminofen no sangue do cordão umbilical foi associado, em análise multivariada, a aumento nas chances de asma em crianças após seis anos de acompanhamento.28
Sempre que possível, evitar o uso de paracetamol e antibióticos de amplo espectro durante o primeiro ano de vida.
Crianças de famílias com baixo nível socioeconômico têm o dobro de chances de desenvolver asma aos 14 anos em comparação com aquelas de famílias de nível socioeconômico mais alto, que apresentam uma probabilidade 60% menor de desenvolver a doença.29 As precárias condições de moradia, que afetam desproporcionalmente as comunidades de baixa renda, são um fator que pode aumentar a incidência e agravar a asma, devido à maior exposição a alérgenos internos, como pragas, ácaros e fungos, além de contribuírem para o surgimento de sibilos durante a infância.30,31
Manifestações Clínicas
A tosse geralmente não produtiva é quase que constante na asma em todos os grupos etários. A asma se constitui na causa mais comum de tosse crônica em crianças de qualquer idade. Pode ser a única manifestação da asma em mais de 57% dos casos,32 ocorrendo principalmente à noite ou durante a madrugada, durante o exercício ou quando a criança chora ou grita.
Na criança, a tosse pode ser o sintoma mais precoce e único (5% dos casos) da doença, visto que a asma não é diagnosticada, às vezes por anos, especialmente se a obstrução brônquica nunca se manifesta de forma intensa o suficiente para gerar oscilações, decorrentes da aceleração e turbilhonamento do ar nas paredes dos pequenos e estreitados brônquios. Nestas ocasiões, durante a ausculta do tórax, não se detectam ruídos adventícios a menos que a criança hiperventile.33,34
 Quando ruídos adventícios estão presentes na ausculta pulmonar, estes podem ser os roncos ou sibilos. A asma é a causa mais comum de sibilos generalizados em crianças e a bronquiolite é a causa mais comum em lactentes. Os sibilos são sons adventícios contínuos polifônicos, de caráter musical, finos, mais agudos, melhor perceptíveis ao final da inspiração e na expiração. O ronco é um ruído rude, escuta-se tanto na inspiração quanto na expiração. Os roncos e sibilos podem ser ouvidos de forma intermitente, às vezes só se produzem em um tempo respiratório, desaparecendo no outro. São ruídos móveis, que desaparecem, amiúde, durante alguns ciclos respiratórios para reaparecerem depois. Com a tosse, não raro, diminuem tanto que se extinguem. Quando ruídos adventícios estão presentes na ausculta pulmonar, estes podem ser os roncos ou sibilos. A asma é a causa mais comum de sibilos generalizados em crianças e a bronquiolite é a causa mais comum em lactentes. Os sibilos são sons adventícios contínuos polifônicos, de caráter musical, finos, mais agudos, melhor perceptíveis ao final da inspiração e na expiração. O ronco é um ruído rude, escuta-se tanto na inspiração quanto na expiração. Os roncos e sibilos podem ser ouvidos de forma intermitente, às vezes só se produzem em um tempo respiratório, desaparecendo no outro. São ruídos móveis, que desaparecem, amiúde, durante alguns ciclos respiratórios para reaparecerem depois. Com a tosse, não raro, diminuem tanto que se extinguem.
A principal característica da asma é a sibilância, porém é bem sabido que nem tudo que sibila é asma. O diagnóstico da asma na criança nem sempre é fácil, principalmente no pré-escolar, pois a incidência de sibilância pode alcançar níveis superiores a 50%, como visto em estatísticas de alguns países tais como Estados Unidos e Austrália.
Nos EUA, um estudo coorte prospectivo acompanhou crianças até 6 anos de idade e constatou que aproximadamente 51,5% de todas as crianças nunca apresentaram sibilos, 19,9% tiveram pelo menos um episódio de sibilância durante os três primeiros anos de vida e estavam assintomáticos aos seis anos, 15% apresentaram o primeiro episódio de sibilos somente após os três anos de idade e persistiam aos seis anos, enquanto que 13,7% apresentaram sibilos antes do três anos e persistiam até os seis anos.35
A sibilância é um achado clínico pouco comum durante os 2 primeiros meses de vida.36 O motivo pelo qual os recém-natos estão protegidos contra a obstrução não é conhecido. Nesta faixa, a apneia e não a sibilância é a manifestação mais frequente da infecção pelo vírus sincicial respiratório (VSR). Após dois meses de idade, a incidência do primeiro episódio de sibilância aumenta, com pico entre o 2º e 5º meses de idade.37 A incidência diminui após o sexto mês e permanece baixa e estável durante o segundo e terceiro anos de vida.38 Cerca de 30-40% das crianças que sibilam antes dos três anos persistem sibilando aos 6 anos de idade.35,39
Sob o ponto de vista epidemiológico, identificam-se três fenótipos mais frequentes de sibilância recorrente, que ocorrem antes dos três anos de idade:40
• |
sibilância transitória precoce |
• |
sibilância não atópica persistente |
• |
sibilância atópica |
➭ Sibilância transitória precoce (60% < 3 anos de idade) – Consiste em um grupo de crianças que apresenta episódios recorrentes de sibilos durante o primeiro ano de vida e mostra aparente remissão quando dos primeiros anos de escola. Cerca de 60% das crianças param de sibilar aos 3 anos de vida. Estas não apresentam maior incidência de história familiar de asma nem história pessoal ou familiar de outras doenças alérgicas como a dermatite atópica, do que aquelas que nunca apresentaram sibilos nos primeiros 6 anos de vida.38,41 Estudos epidemiológicos demonstram que crianças que pertencem a este grupo tendem a ter sintomas quase que exclusivamente durante infecções virais. Devido às características anátomo-funcionais desta faixa etária as infecções virais podem evoluir com obstrução das vias aéreas o que determina edema de mucosa e aumento de secreções, com expressão clínica de tosse, chiado e roncos. Um outro fator de risco para a sibilância precoce transitória está relacionado ao hábito tabágico materno. Esta associação pode ser explicada, pelo menos em parte, pelas menores dimensões das vias aéreas em crianças cujas mães fumam.38
➭ Sibilância não atópica persistente (20% < 3 anos de idade) – Como já citado, 30-40% das crianças que sibilam durante os três primeiros anos de vida continuarão a apresentar episódios de sibilos aos 6 anos de idade. Apenas metade destas apresentam evidências de sensibilização contra aeroalérgenos locais, o que contrasta com > 90% das crianças alérgicas entre aquelas que sibilam aos treze anos.42 Neste grupo ocorre nítida relação com as infecções virais. As que sibilam neste grupo apresentam maior incidência de sintomas durante o inverno, quando as infecções virais são mais prevalentes na comunidade. As infecções virais que aumentam o risco de sibilância persistente não atópica em indivíduos susceptíveis são capazes, no entanto, de diminuir o risco de sensibilização alérgica e sibilância atópica, através do estímulo da imunidade mediada via desvio Th1.
➭ Sibilância atópica (20% < 3 anos de idade) – Corresponde a 20% do total. De início, os futuros sibilantes atópicos não podem ser distinguidos clinicamente das outras crianças que chiam durante os primeiros três anos de vida. A sibilância usualmente inicia-se um pouco mais tarde neste grupo do que nos outros dois, com frequência mais elevada durante o segundo e terceiro anos de vida. Tendem a apresentar sintomas mais severos. Uma cuidadosa anamnese pode ser importante, pois as crianças com sibilância atópica apresentam quatro vezes mais relatos de asma na família e cerca de duas a três vezes mais relatos de dermatite atópica do que os outros grupos para a mesma faixa de idade. Apenas em uma minoria de crianças, que serão classificadas mais tarde como atópicas, os testes cutâneos são positivos para aeroalérgenos. O mesmo ocorre com a detecção de IgE específica para aeroalérgenos que nesta população é baixa. Estes testes só se tornarão positivos meses ou anos após os primeiros episódios de sibilância.
Na Figura 2 identificam-se os três fenótipos mais frequentes de sibilância recorrente, cujos sintomas iniciam antes dos três anos de idade: sibilância transitória precoce, sibilância não atópica persistente e sibilância atópica.
 Infelizmente, na prática clínica, torna-se muito difícil identificar no universo de crianças que apresentam sibilos nos três primeiros anos de vida, a minoria que evoluirá para a asma no período pré-escolar, escolar e adulto. Não se dispõe no momento de nenhum marcador genético ou bioquímico para tal. Vários estudos longitudinais tentam responder esta questão. O de Melbourne, Austrália, avaliou crianças em diferentes estágios de gravidade, abrangendo a faixa etária de 7 a 10 anos.43 Constatou-se que a gravidade da asma modifica-se pouco no decurso do tempo, ou seja, crianças com asma mais severa durante os anos escolares foram as que se tornaram pacientes mais graves quando adultos. Já as crianças com asma leve ou pouco frequente apresentavam-se com asma leve intermitente na idade adulta ou com remissão completa da doença. Constatou-se que aquelas que sibilavam durante os três primeiros anos de vida, e cuja sintomatologia persistia aos 6 anos, apresentavam provas de função respiratória com valores inferiores aos das crianças cuja sibilância se iniciara após os três anos. Estes dados demonstram que o início precoce dos sintomas de asma está associado à deterioração funcional pulmonar e ao maior índice de persistência da doença na idade adulta. Este é o principal motivo pelo qual se deve tentar identificar precocemente quais crianças apresentam sibilos transitórios não relacionados à doença, daquelas que evoluirão para a asma brônquica na idade escolar e adulta, pois um tratamento específico se impõe, objetivando a preservação funcional pulmonar e a atenuação evolutiva da asma, modificando-se o curso da mesma. Infelizmente, na prática clínica, torna-se muito difícil identificar no universo de crianças que apresentam sibilos nos três primeiros anos de vida, a minoria que evoluirá para a asma no período pré-escolar, escolar e adulto. Não se dispõe no momento de nenhum marcador genético ou bioquímico para tal. Vários estudos longitudinais tentam responder esta questão. O de Melbourne, Austrália, avaliou crianças em diferentes estágios de gravidade, abrangendo a faixa etária de 7 a 10 anos.43 Constatou-se que a gravidade da asma modifica-se pouco no decurso do tempo, ou seja, crianças com asma mais severa durante os anos escolares foram as que se tornaram pacientes mais graves quando adultos. Já as crianças com asma leve ou pouco frequente apresentavam-se com asma leve intermitente na idade adulta ou com remissão completa da doença. Constatou-se que aquelas que sibilavam durante os três primeiros anos de vida, e cuja sintomatologia persistia aos 6 anos, apresentavam provas de função respiratória com valores inferiores aos das crianças cuja sibilância se iniciara após os três anos. Estes dados demonstram que o início precoce dos sintomas de asma está associado à deterioração funcional pulmonar e ao maior índice de persistência da doença na idade adulta. Este é o principal motivo pelo qual se deve tentar identificar precocemente quais crianças apresentam sibilos transitórios não relacionados à doença, daquelas que evoluirão para a asma brônquica na idade escolar e adulta, pois um tratamento específico se impõe, objetivando a preservação funcional pulmonar e a atenuação evolutiva da asma, modificando-se o curso da mesma.
Vários estudos demonstraram ser possível um alto nível de precisão diagnóstica visando identificar crianças menores de três anos com risco elevado para asma, utilizando-se certos índices clínicos. Castro-Rodriguez et al.,44 a partir de dados do Tucson Children's Respiratory Study desenvolveram dois índices preditivos de asma, que utilizam critérios maiores e menores para avaliar o risco de asma em crianças com história de sibilos recorrentes. Os critérios maiores foram a presença de asma nos pais, especialmente a asma materna e a dermatite atópica diagnosticada por um médico. Os critérios menores incluíam a rinite alérgica, eosinofilia (≥ 4%) e sibilos não relacionados aos resfriados. Este índice recebeu a denominação de "índice limitado". Neste a criança sob potencial risco de desenvolver asma na idade escolar deveria manifestar sibilos recorrentes durante os três primeiros anos de vida e apresentar pelo menos um dos dois critérios maiores ou dois dos três menores. A combinação de fatores maiores e menores foi escolhida porque fornecia maior valor preditivo e maior especificidade.
Em crianças com ≤ 5 anos, a sibilância recorrente é comum, mas a asma é mais provável se elas apresentarem sibilos ou tosse com exercício / riso / choro ou na ausência de infecções respiratórias e se tiverem histórico de eczema ou rinite alérgica.
Infecção Viral, Sibilos e Asma
Em crianças, a infecção viral comumente causa sibilos. Mais de 70% dos episódios de sibilância no primeiro ano de vida estão relacionados às infecções virais respiratórias.45 Nas menores de dois anos o agente causal mais comum é o Vírus Sincicial Respiratório (VSR), um ARN paramixovírus, sendo também o maior agente causador das bronquiolites virais (80%).
O mecanismo pelo qual o VSR desencadeia a sibilância está associado a uma resposta de células T caracterizada principalmente pela produção de citocinas Th2, a mesma resposta observada durante os episódios de asma. Ambas são caracterizadas pelo recrutamento de células T e eosinófilos bem como pela liberação de mediadores solúveis como a histamina, as cininas e os leucotrienos. Entre as crianças com bronquiolite, a sibilância mais severa e frequente correlaciona-se com os elevados níveis de anticorpos IgE contra o VSR e o vírus parainfluenza nas secreções respiratórias, sugerindo que os anticorpos induzidos pelos vírus aumentam a liberação de mediadores inflamatórios, importantes na responsividade brônquica. O VSR pode favorecer ainda o broncospasmo através de vias neurais que medeiam a responsividade das vias aéreas.
Aproximadamente uma em cada cinco crianças sibilam em decorrência da infecção pelo VSR, porém somente 15% destas desenvolverão asma persistente. O porquê ainda não está bem estabelecido, embora existam hipóteses. Acredita-se que a bronquiolite inflamatória pós-infecção tenha forte potencial de injúria ao nível das vias aéreas, determinando o seu remodelamento. Estas alterações permanentes influenciariam o crescimento pulmonar, causando sibilância persistente. Outra possibilidade propõe que a infecção pelo VSR, em indivíduos geneticamente propensos à atopia, possa influenciar o desenvolvimento do sistema imune, tornando o paciente mais alérgico.
Acima de 2 anos à idade adulta, as infecções virais são causadas principalmente pelos rinovírus e coronavírus, ocorrendo forte associação entre rinovírus e asma.46,47
A família dos picornavirídeos é a fonte mais comum de infecções virais no mundo.48 Recebem este nome devido ao seu ínfimo tamanho (aproximadamente 30 nm). São vírus RNA, ubíquos e incluem além dos rinovírus humanos, os enterovírus, cardiovírus e os aphtovírus.49 O rinovírus é o responsável por cerca de 60% dos resfriados comuns. Existem mais de 100 sorotipos diferentes, os quais apresentam pequenas diferenças na sequência genética e estrutura antigênica. O rinovírus infecta pacientes de qualquer idade, em qualquer época do ano, sendo mais prevalente, entretanto, no inverno. Adenovírus, parainfluenza e coronavírus são detectados com menos frequência. O coronavírus causa sintomas semelhantes ao rinovírus, sendo responsável por aproximadamente 15-20% dos resfriados comuns, determinando mais infecções do trato respiratório inferior do que superior, estando associado frequentemente às exacerbações da asma. Existem dois grupos antigênicos principais de coronavírus, conhecidos como 229E e OC43.
Imunologia da Sibilância nos Primeiros Anos de Vida
O início da sibilância atópica e não atópica é o resultado de uma complexa interação entre a predisposição genética, a exposição ambiental e os padrões de desenvolvimento tanto das respostas imunes quanto do desenvolvimento do sistema broncopulmonar. A persistência nos primeiros anos de vida de baixas respostas do interferon gama (IFN-g), que é uma característica dos lactentes, predispõe as crianças a episódios de sibilância (transitória) durante as infecções virais. O determinante mais importante da maturação de respostas IFN-g é a exposição aos produtos bacterianos, como a endotoxina. A endotoxina é um componente da parede celular das bactérias gram-negativas, sendo encontrada na natureza nas fezes de animais (especialmente em animais de fazenda). Estudos in vitro demonstraram que a endotoxina é capaz de modificar o tipo de resposta imune produzida pelas células T. Estimula a produção pelas células dendríticas, de IL-12 que induz as células Th1 e as células assassinas natural killer a produzirem o interferon-g e, desse modo, desviam o sistema imune para uma resposta Th1, com ação protetora contra a alergia, reduzindo a produção de citocinas Th2 (IL-4, 5, 6), importantes na imunopatogênese das doenças alérgicas. Em crianças que não apresentam predisposição genética a alergias, a sibilância não atópica é capaz de persistir enquanto permanecer o déficit de respostas IFN-g, podendo alcançar o período escolar. Nas crianças com predisposição genética para o desenvolvimento de respostas Th2, baixas respostas IFN-g irão predispor a sensibilização precoce à exposição a concentrações muito baixas de alérgenos. Como consequência, estas crianças estarão mais propensas a desenvolver respostas Th2 contra vários antígenos, de início contra antígenos de alimentos e, ao longo do tempo, contra aeroalérgenos. Além da tosse e da sibilância, a criança com asma apresenta no exame físico à inspeção e à palpação:
● Taquipneia. Levar em consideração a idade da criança (Tabela 1)
Tabela 1 —Frequência Respiratória Normal em Função da Idade
Idade |
Frequência Normal |
< 2 meses |
< 60/min |
2–12 meses |
< 50/min |
1–5 anos |
< 40/min |
6–8 anos |
< 30/min |
● Mudança na coloração dos lábios (palidez, cianose) e do leito ungueal (cianose)
● Deformidades torácicas – "tórax pseudorraquítico" nas crianças asmáticas desde tenra idade, tonel etc
● Tiragem intercostal – retração inspiratória dos espaços intercostais, fossa supraesternal, regiões supraclaviculares e subcostais devido à obstrução
● Utilização da musculatura acessória, principalmente nas grandes dispneias, mobilizando os músculos inspiratórios auxiliares como os esternocleidomastoideos e escalenos
● Tempo expiratório forçado, prolongando a expiração ao mesmo tempo em que aperta os lábios, deixando apenas uma pequena fenda central na comissura labial (posição de "assovio")
● Taquicardia. Levar em conta a idade da criança (Tabela 2)
Tabela 2— Frequência Cardíaca Normal em Função da Idade
Idade |
Frequência Normal |
2–12 meses |
< 160/min |
1–2 anos |
< 120/min |
2–8 anos |
< 110/min |
● Pulso paradoxal (PP) – consiste na diminuição acentuada da amplitude do pulso e até mesmo o seu desaparecimento, associado à diferença de pressão sistólica entre a inspiração e a expiração. Na inspiração em pessoas normais a pressão arterial sistólica diminui > 10 mm Hg. Este aumento na variabilidade da pressão intratorácica influencia o retorno venoso e por isso afeta o débito cardíaco e a pressão de ejeção do ventrículo esquerdo. Na asma aguda a pressão pleural é muito negativa na inspiração, ocorrendo grande redução na pressão intratorácica (–30 – –20 mm Hg). Mecanismos relacionados a estas grandes oscilações na pressão pleural foram propostas para explicar o pulso paradoxal, afetando a pressão arterial sistólica: por ação direta (transmissão passiva ao longo da árvore arterial) e indireta (diminuição do débito cardíaco ventricular esquerdo). O pulso paradoxal pode ser medido com o esfigmomanômetro, à beira do leito. O valor normal do PP para as crianças na asma severa varia de 20–40 mm Hg. A ausência de elevação no PP pode significar agravamento, pois, à medida que a insuficiência respiratória progride, ocorre diminuição do esforço inspiratório por fadiga muscular e as oscilações na pressão intratorácica podem ser menores.
Diagnóstico Diferencial
Várias patologias são capazes de reduzir a luz das vias aéreas, com manifestações estetoacústicas semelhantes às observadas na asma brônquica. Na Tabela 3 são apresentadas as principais doenças que fazem diagnóstico diferencial da asma nas crianças.
Tabela 3— Diagnóstico Diferencial da Asma na Infância
Diagnóstico Diferencial da Asma na Infância |
Trato Respiratório Alto |
Trato Respiratório Médio |
Trato Respiratório Inferior |
Rinite Alérgica |
Estenose brônquica |
Bronquiectasias |
Hipertrofia amigdaliana / adenoides |
Linfonodomegalias |
Displasia broncopulmonar |
Corpo estranho |
Epiglotite |
Chlamydia trachomatis |
Rinite infecciosa |
Corpo estranho |
Aspiração crônica |
Sinusite |
Laringotraqueobronquite |
Refluxo gastresofagiano |
|
Coqueluche |
Síndrome de hiperventilação |
|
Inalação tóxica |
Bronquiolite obliterante |
|
Fístula traqueoesofagiana |
Hemosiderose pulmonar |
|
Estenose traqueal |
Inalação tóxica |
|
Traqueomalácia |
Tumor |
|
Tumor |
Bronquiolite viral |
|
Aneis vasculares |
|
|
Disfunção das cordas vocais |
|
|
Adaptado de Lemanske PP Jr, Green GG. – Asthma in infancy and chilwood. In: E Midleton JR, CE Reed, EF Ellis, et al., eds Allergy: Principles & Practice. 5º Ed, St Louis, Mc Mosby-Year-Book, Inc; 1998:878. |
Exploração Funcional Respiratória
 O relatório da Estratégia Global para Gestão e Prevenção da Asma (GINA) afirma que o diagnóstico de asma não deve ser baseado apenas nos sintomas. Todas as crianças com asma devem se submeter aos testes de função respiratória tão logo seja possível. Crianças acima de quatro anos são capazes de executar as manobras com razoável sucesso. Os testes de função respiratória auxiliam no diagnóstico e monitoramento da doença. Praticamente todos os testes podem se alterar. Estes podem se apresentar normais nos assintomáticos fora de crise ou com os mais variados graus de obstrução em função do estágio da doença em que o paciente se encontra. As medidas mais comuns e fáceis de serem obtidas são aquelas através de manobra expiratória forçada: Capacidade Vital Forçada (CVF), Volume Expiratório Forçado no primeiro segundo (VEF1), a relação VEF1/CVF e o Fluxo Máximo-Médio Expiratório Forçado da Capacidade Vital (FEF 25-75%) (Figura 3). A diferença entre a Capacidade Vital "lenta" (CV) e a Capacidade Vital Forçada (CVF) é vista frequentemente em pacientes com obstrução brônquica, sendo um sinal de air trapping. O relatório da Estratégia Global para Gestão e Prevenção da Asma (GINA) afirma que o diagnóstico de asma não deve ser baseado apenas nos sintomas. Todas as crianças com asma devem se submeter aos testes de função respiratória tão logo seja possível. Crianças acima de quatro anos são capazes de executar as manobras com razoável sucesso. Os testes de função respiratória auxiliam no diagnóstico e monitoramento da doença. Praticamente todos os testes podem se alterar. Estes podem se apresentar normais nos assintomáticos fora de crise ou com os mais variados graus de obstrução em função do estágio da doença em que o paciente se encontra. As medidas mais comuns e fáceis de serem obtidas são aquelas através de manobra expiratória forçada: Capacidade Vital Forçada (CVF), Volume Expiratório Forçado no primeiro segundo (VEF1), a relação VEF1/CVF e o Fluxo Máximo-Médio Expiratório Forçado da Capacidade Vital (FEF 25-75%) (Figura 3). A diferença entre a Capacidade Vital "lenta" (CV) e a Capacidade Vital Forçada (CVF) é vista frequentemente em pacientes com obstrução brônquica, sendo um sinal de air trapping.
A redução do calibre e consequente aumento na resistência das vias aéreas determina diminuição de todos os fluxos expiratórios máximos, incluindo o Pico de Fluxo Expiratório (PFE) que, na asma aguda infantil, pode ser menor do que 40 l/min. Ocorrem ainda diminuição dos volumes expirados em função do tempo, oclusão prematura das vias aéreas, hiperinsuflação pulmonar, aumento do trabalho respiratório com mudanças na performance muscular e alterações na relação ventilação-perfusão com alteração nos gases sanguíneos.
 A reversibilidade da obstrução das vias aéreas pode ser avaliada através do teste de broncodilatação, medindo-se o VEF1 antes e 10 a 15 minutos após a inalação de duas respirações profundas de broncodilatador de curta ação – Salbutamol (200–400 mcg). Arbitrariamente considera-se um aumento ≥ 12% (ou 200 ml) no VEF1 como evidência de significativa reversibilidade. A reversibilidade da obstrução das vias aéreas pode ser avaliada através do teste de broncodilatação, medindo-se o VEF1 antes e 10 a 15 minutos após a inalação de duas respirações profundas de broncodilatador de curta ação – Salbutamol (200–400 mcg). Arbitrariamente considera-se um aumento ≥ 12% (ou 200 ml) no VEF1 como evidência de significativa reversibilidade.
Os Fluxos Expiratórios Máximos obtidos através da curva fluxo-volume (Vmáx75%CVF, Vmáx50%CVF, Vmáx25%CVF, e o PFE) encontram-se diminuídos, elevando-se após o teste com o broncodilatador (Figura 4).
Quanto à avaliação dos resultados obtidos na espirometria é importante salientar que crianças com a mesma altura podem ter padrões de crescimento e desenvolvimento pulmonares diferentes. Portanto, esta informação deve ser levada em conta quando comparamos os valores obtidos aos das tabelas de valores teóricos preditos. Por exemplo, não é raro encontrar uma criança sibilando com um VEF1 de 90–100% do teórico que se eleva 15–20% após o teste de broncodilatação. Por outro lado, crianças com VEF1 de 70-80% do teórico, em função de tabelas para a idade e altura podem não ter asma. Torna-se necessário estar atento para estas variações, evitando-se superestimar ou subestimar o grau de obstrução, o que pode ter impacto no diagnóstico correto da doença bem como nas formas de tratamento.
Outro teste diagnóstico considerado como de primeira linha para todas as crianças sob investigação de asma, embora ainda não disponibilizado em todas as unidades de saúde,
a Fração exalada de Óxido Nítrico (FeNO) deve ser efetuada como parte da investigação em crianças a partir de cinco anos de idade.50-53 Um valor de FeNO ≥ 25 ppb em uma criança com sintomas de asma é um parâmetro considerado como altamente preditivo para o diagnóstico de asma.54 Um valor de FeNO < 25 ppb não exclui asma. Quando os resultados são elevados, podem significar inflamação eosinofílica, merecendo investigação criteriosa, principalmente se houver história de asma em algum período da vida. A sensibilidade do teste FeNO é alta em pacientes não tratados.55
O teste de broncoprovocação – direto ou indireto – e a avaliação da variabilidade excessiva média diária do PFE são testes recomendados para todas as crianças quando o diagnóstico permanece sem definição após as investigações iniciais.54
• Quando um teste de provocação com metacolina apresentar uma PC20 ≤ 8 mg/ml ele é considerado positivo. Testes de provocação com manitol podem ser desagradáveis para as crianças e devem ser evitados. Nenhuma evidência foi encontrada para o uso da histamina.
• O teste de provocação indireto de exercício na esteira ou bicicleta com queda no VEF1 de > 10% do valor basal deve ser interpretado como positivo.
• Uma variabilidade diurna no teste de PFE ≥ 12% deve ser considerada positiva. Se um teste de variabilidade do PFE for utilizado, o resultado deve ser baseado em duas semanas de medições. Uma variabilidade < 12%, entretanto, não exclui asma.
Biagini Myers et at.56 e seus colegas desenvolveram o Escore de Risco de Asma Pediátrica (PARS), uma ferramenta on-line gratuita57 para avaliar o risco de asma em crianças pequenas.
➢ Segundo a GINA, considerar para crianças com ≤ 5 anos o encaminhamento para parecer com o especialista para investigação diagnóstica complementar — isto na eventualidade da não confirmação do diagnóstico de asma, se houver história de início muito precoce dos sintomas, falha na resposta terapêutica ou na presença de características que possam sugerir diagnósticos alternativos – p. ex. hipoxemia, baqueteamento digital, retardo de crescimento.58
As crianças, seus pais e todos os responsáveis que delas se ocupam, incluindo os educadores, precisam ser instruídos sobre como controlar a asma. Todos devem ser instruídos sobre "como", "por que" e "quando" precisam usar os medicamentos adequados, aprender a reconhecer quando a asma não está controlada para monitorar a sua doença através dos sintomas ou utilizar medidores de PFE e saber quando se deve buscar atendimento médico de emergência.
|
Referências
01.Centers for Disease Control and Prevention. (2022). CDC – Asthma – Data and Surveillance – Asthma Surveillance Data. [online] Disponível na internet: https://www.cdc.gov/asthma/most_recent_national_asthma_data.htm Acesso em 14 março 2023.
02.Selroos O, Kupczyk M, Kuna P, Lacwik P, Bousquet J, Brennan D, Palkonen S, Contreras J, FitzGerald M, Hedlin G, Johnston SL, Louis R, Metcalf L, Walker S, Moreno-Galdó A, Papadopoulos NG, Rosado-Pinto J, Powell P, Haahtela T. National and regional asthma programmes in Europe. Eur Respir Rev 2015;24: 474-83.
03.NHS England. Childhood asthma. Disponível na internet: https://www.england.nhs.uk/childhood-asthma/ Acesso em 10 de novembro de 2024.
04.Litonjua AA, Gold DR. Asthma and obesity: Common early-life influences in the inception of disease. J Allergy Clin Immunol 2008;121:1075-84.
05.Worldwide variation in prevalence of symptoms of asthma, allergic rhinoconjunctivitis, and atopic eczema: ISAAC. The International Study of Asthma and Allergies in Childhood (ISAAC) Steering Committee. Lancet 1998; 351:1225.
06.Global Athma Network. The Global Asthma Report 2022. Disponível em: http://globalasthmareport.org/
07.Zimmerman B, Feanny S, Reisman J, Hak H, Rashed N, McLaughlin FJ, Levison H. Allergy in asthma. I. The dose relationship of allergy to severity of childhood asthma. J Allergy Clin Immunol 1988; 81:63-70.
08.Stempel DA, Clyde WA Jr, Henderson FW, Collier AM. Serum IgE levels and the clinical expression of respiratory illnesses. J Pediatr 1980; 97:185-90.
09.
Office of the Surgeon General (US); Office on Smoking and Health (US). The Health Consequences of Smoking: A Report of the Surgeon General. Atlanta (GA): Centers for Disease Control and Prevention (US); 2004. PMID: 20669512.
10.Burke H, Leonardi-Bee J, Hashim A, Pine-Abata H, Chen Y, Cook DG, Britton JR, et al. Prenatal and passive smoke exposure and incidence of asthma and wheeze systematic review and meta-analysis. Pediatrics 2012;129:735-44.
11.Liu J, Bowatte G, Pham J, Perret JL, Holloway JW, Lowe AJ, Burgess JA, Svanes C, Thomas P, Russell MA, Erbas B, Lodge CJ, Martino D, Mishra GD, Abramson MJ, Walters EH, Dharmage SC, Bui DS. Pre-pubertal smoke exposure of fathers and increased risk of offspring asthma: a possible transgenerational effect. Eur Respir J 2022; 14:2200257. doi: 10.1183/13993003.00257-2022. Epub ahead of print. PMID: 36104290.
12.Li X, Zhang Y, Zhang R, Chen F, Shao L, Zhang L. Association Between E-Cigarettes and Asthma in Adolescents: A Systematic Review and Meta-Analysis. Am J Prev Med 2022; 62:953-960.
13.Camargo CA Jr, Weiss ST, Zhang S, Willett WC, Speizer FE. Prospective study of body mass index, weight change, and risk of adult-onset asthma in women. Arch Intern Med 1999; 159:2582-8.
14.Beuther DA, Sutherland ER. Overweight, obesity, and oungnte asthma: a meta-analysis of prospective epidemiologic studies. Am J Respir Crit Care Med. 2007; 175:661-6.
15.Dixon AE, Holguin F, Sood A, Salome CM, Pratley RE, Beuther DA, Celedón JC, Shore VER; American Thoracic Society Ad Hoc Subcommittee on Obesity and Lung Disease. An official American Thoracic Society Workshop report : obesity and asthma. Proc Am Thorac Soc 2010 ; 7 :325-35.
16.Hu M, Zhao X, Liu Y, Zhou H, You Y, Xue Z. Complex interplay of gut microbiota between obesity and asthma in children. Front Microbiol 2023; 14:1264356.
17.Malden S, Gillespie J, Hughes A, Gibson AM, Farooq A, Martin A, Summerbell C, Reilly JJ. Obesity in oung children and its relationship with diagnosis of asthma, vitamin D deficiency, iron deficiency, specific allergies and flat-footedness: A systematic review and meta-analysis. Obes Ver 2021; 22:e13129.
18.Rosenquist NA, Richards M, Ferber JR, Li DK, Ryu SY, Burkin H, Strickland MJ, Darrow LA. Prepregnancy body mass index and risk of childhood asthma. Allergy 2023; 78:1234-1244.
19.Patrick DM, Sbihi H, Dai DLY, Al Mamun A, Rasali D, Rose C, Marra F, Boutin RCT, Petersen C, Stiemsma LT, Winsor GL, Brinkman FSL, Kozyrskyj AL, Azad MB, Becker AB, Mandhane PJ, Moraes TJ, Sears MR, Subbarao P, Finlay BB, Turvey SE. Decreasing antibiotic use, the gut microbiota, and asthma incidence in children : evidence from population-based and prospective cohort studies. Lancet Respir Med. 2020 Nov;8(11):1094-1105.
20.Kozyrskyl AL, Mai XM, McGrath P, Hayglass KT, Becker AB, Macnell B. Continued exposure to maternal distress in early life is associated with an increased risk of childhood asthma. Am J Respir Crit Care Med 2008;177;142-7.
21.Marra F, Marra CA, Richardson K, Lynd LD, Kozyrskyj A, Patrick DM, Bowie WR, et al. Antibiotic use in children is associated with increased risk of asthma. Pediatrics 2009;123:1003-10.
22.Stensballe LG, Simonsen J, Jensen SM, Bonnelykke K, Bisgaard H. Use of antibiotics during pregnancy increases the risk of asthma in early childhood. J Pediatr 2013 162:832-8.
23.Martinez FD. Childhood Asthma Inception and Progression: Role of Microbial Exposures, Susceptibility to Viruses and Early Allergic Sensitization. Immunol Allergy Clin North Am 2019; 39:141-150.
24.Lee E, Park YM, Lee SY, Lee SH, Park MJ, Ahn K, Kim KW, Shin YH, Suh DI, Hong SJ. Associations of prenatal antibiotic exposure and delivery mode on childhood asthma inception. Ann Allergy Asthma Immunol 2023; 131:52-58.e1.
25.Melén E, Zar HJ, Siroux V, Shaw D, Saglani S, Koppelman GH, Hartert T, Gern JE, Gaston B, Bush A, Zein J. Asthma Inception: Epidemiologic Risk Factors and Natural History Across the Life-Course. Am J Respir Crit Care Med 2024 Jul 9. PMID:38981012.
26.Etminan M, Sadatsafavi M, Jafari S, Doyle-Waters M, Aminzadeh K, FitzGerald JM. Acetaminophen use and the risk of asthma in children and adults: a systematic review and metaanalysis. Chest 2009; 136:1316-1323.
27.Eyers S, Weatherall M, Jefferies S, Beasley R. Paracetamol in pregnancy and the risk
of wheezing in offspring: a systematic review and meta-analysis. Clin Exp Allergy
2011; 41:482-489.
28. Li Y, Hong X, Chandran A, Keet CA, Clish CB, Liang L, Jacobson LP, Wang X, Ladd-Acosta C. Associations between cord blood acetaminophen biomarkers and childhood asthma with and without allergic comorbidities. Ann Allergy Asthma Immunol 2024; 132:705-712.e5.
29.Kozyrskyj AL, Kendall GE, Jacoby P, Sly PD, Zubrick SR. Association between socioeconomic status and the development of asthma: analyses of income trajectories. Am J Public Health 2010; 100:540-546.
30.Devereux G, Litonjua AA, Turner SW, Craig LC, McNeill G, Martindale S, Helms PJ, Seaton A, Weiss ST. Maternal vitamin D intake during pregnancy and early childhood wheezing. Am J Clin Nutr 2007; 85:853-9.
31.Camargo CA Jr, Rifas-Shiman SL, Litonjua AA, Rich-Edwards JW, Weiss ST, Gold DR, Kleinman K, Gillman MW. Maternal intake of vitamin D during pregnancy and risk of recurrent wheeze in children at 3 y of age. Am J Clin Nutr 2007; 85:788-95.
32.Irwin RS, Corrao WM, Pratter MR. Chronic persistent cough in the adult: the spectrum and frequency of causes and successful outcome of specific therapy. Am Rev Respir Dis 1981;123:413-417.
33.Bohadana AB. Sons pulmonares. J Pneumol 1984; 10:101.
34.Forgacs P. Lungs Sounds, Baililière, 1978.
35.Martinez FD, Wright AL, Taussig LM et al. Asthma and wheezing in the first six ears of life. N Engl J Med 1995; 332:133.
36.Wright AL, Taussig LM, Ray CG et al. The Tucson Children's Respiratory Study. II. Lower respiratory tract illness in the first year of life. Am J Epidemiol 1989; 129:1232.
37.Holberg CJ, Wright AL, Martinez FD et al. Risk factors for respiratory syncytial virus-associated lower respiratory illness in the first year of life. Am J Epidemiol 1991; 133:1135.
38.Rakes GP, Arruda E, Ingram JM et al. Rhinovirus and respiratory syncytial virus in wheezing children requiring emergency care. IgE and eosinophil analyses. Am J resp Crit Care Med 1999; 159:785.
39.Sherriff A, Peters TJ, Hemderson J, Strachan D. Risk factor associations with wheezing patterns in children followed longitudinally from birth to 3(1/2) years. Int J Epidemiol 2001; 30:1473.
40.Martinez, FD, Godfrey, S. – Wheezing Disorders. 1ª edição. Londres: Martin Dunitz; 2003.
41.Rusconi F, Galassi C, Corbo GM et al. Risk factors for early, persistent, and late-onset wheezing in young children. SIDRIA Collaborative Group. Am J Resp Crit Care Med 1999; 160:1617.
42.Burrows B, Sears MR, Flannery EM et al. Relations of bronchial responsiveness to allergy skin test reactivity, lung function, respiratory symptoms, and diagnoses in thirteen-year-old New Zealand children. J Allergy Clin Immunol 1995; 95:248.
43.Kelly WJ, Hudson I, Phelan PD, Pain MC, Olinsky A. Atopy in subjects with asthma followed to the age of 28 years. J Allergy Clin Immunol 1990; 85:548.
44.Castro-Rodriguez JA, Holberg CJ, Wright AL, Manrtinez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. AM J Respir Crit Care Med 2000; 162:1403.
45.Wright AL, Holberg CJ, Martinez FD, Morgan WJ, Taussig LM. Breast feeding and lower respiratory tract illness in the first year of life. Br Med J 1989; 299:946.
46.Johnston SL, Pattemore PK, Sanderson G, Smith S, Lampe F, Josephs L, Sympington P, O'Toole S, Myint SH, Tyrrell DA, Holgate ST. Community study of role of viral infections in exacerbations of asthma in 9-11 year old children. Br Med J 1995; 310:1225.
47.Duff AL, Pomeranz ES, Gelber LE, Price GW, Farris H, Hayden FG, Platts-Mills TAE, Heymann RW. Risk factors in acute wheezing in infants and children: viruses, passive smoke, and IgE antibodies to inhalant allergens. Peds 1993; 92:535.
48.Rotbart HA, Hayden FG. Picornavirus infections: a primer for practitioner. Arch Fam Med 2000; 9:913.
49.Temte JL. A family physician's perspective on picornavirus infections in primary care. Arch Fam Med 2000;9:921-2.
50.Guo Z, Wang Y, Xing G, Wang X. Diagnostic accuracy of fractional exhaled nitric oxide in asthma: a systematic review and meta-analysis of prospective studies. J Asthma 2016;53: 404-12.
51.Wang Z, Pianosi PT, Keogh KA, Zaiem F, Alsawas M, Alahdab F, Almasri J, Mohammed K, Larrea-Mantilla L, Farah W, Daraz L, Barrionuevo P, Morrow AS, Prokop LJ, Murad MH. The Diagnostic Accuracy of Fractional Exhaled Nitric Oxide Testing in Asthma: A Systematic Review and Meta-analyses. Mayo Clin Proc 2018;93: 191-198.
52.Karrasch S, Linde K, Rücker G, Sommer H, Karsch-Völk M, Kleijnen J, Jörres RA, Schneider A. Accuracy of FENO for diagnosing asthma: a systematic review. Thorax 2017;72: 109-116.
53.Tang S, Xie Y, Yuan C, Sun X, Cui Y. Fractional Exhaled Nitric Oxide for the Diagnosis of Childhood Asthma: a Systematic Review and Meta-analysis. Clin Rev Allergy Immunol 2019;56: 129-138.
54.Gaillard EA, Kuehni CE, Turner S, Goutaki M, Holden KA, de Jong CCM, Lex C, Lo DKH, Lucas JS, Midulla F, Mozun R, Piacentini G, Rigau D, Rottier B, Thomas M, Tonia T, Usemann J, Yilmaz O, Zacharasiewicz A, Moeller A. European Respiratory Society clinical practice guidelines for the diagnosis of asthma in children aged 5-16 years. Eur Respir J 2021 Nov 4;58(5):2004173. doi: 10.1183/13993003.04173-2020. PMID: 33863747.
55.Frew AJ, Langley SJ, Perrin V, Hertog MG. Effects of 4-week treatment with low-dose budesonide (100 micrograms BID) from a novel inhaler Airmax and from a conventional inhaler on bronchial hyper-responsiveness, lung function and symptoms in patients with mild asthma. Respir Med 2002;96: 542-547.
56.Biagini Myers JM, Schauberger E, He H, et al. A Pediatric Asthma Risk Score to better predict asthma development in young children. J Allergy Clin Immunol . 2019;143(5):1803-1810.e 2.
57.New Tool to Predict Childhood Asthma. Medscape Medical News , May 15, 2019. ATS 2019. International Conference: Abstract 410.
58.Reddel HK, Bacharier LB, Bateman ED, Brightling CE, Brusselle GG, Buhl R, Cruz AA, Duijts L, Drazen JM, FitzGerald JM, Fleming LJ, Inoue H, Ko FW, Krishnan JA, Levy ML, Lin J, Mortimer K, Pitrez PM, Sheikh A, Yorgancioglu AA, Boulet LP. Global Initiative for Asthma Strategy 2021: Executive Summary and Rationale for Key Changes. Am J Respir Crit Care Med 2022;205: 17-35.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|