|
Asma
DIAGNÓSTICO DA ASMA
A asma é uma daquelas doenças para as quais os critérios diagnósticos não são absolutos. Geralmente o seu diagnóstico não exige a confirmação de todas as suas características. Na maioria dos casos a história clínica típica e a presença de fatores de risco já sugerem o diagnóstico, que pode ser confirmado através da espirometria com teste de broncodilatador ou variação no Pico de Fluxo Expiratório (PFE) ao longo do tempo e com o tratamento.
Critérios para o Diagnóstico da Asma
|
• |
Em geral apresentam mais de um sintoma respiratório: sibilos, dispneia, opressão torácica e tosse. Em adultos raramente a tosse isolada se deve à asma |
• |
Os sintomas variam ao longo do tempo em intensidade |
• |
Os sintomas costumam ser piores à noite ou ao caminhar |
• |
Os sintomas são frequentemente desencadeados por esforço, riso, alérgenos, ar frio |
• |
Os sintomas com frequência se manifestam ou se agravam com as infecções virais |
Abaixo são enumeradas algumas perguntas úteis, capazes de legitimar o diagnóstico da doença. No caso de qualquer uma das respostas ser positiva, considerar o diagnóstico de asma.
Perguntas a Serem Efetuadas na Suspeita do Diagnóstico de Asma |
• |
O paciente apresentou uma crise ou crises recorrentes de dificuldade respiratória com sibilos? |
• |
O paciente refere tosse à noite? |
• |
O paciente apresenta dificuldade respiratória com sibilos ou tosse após o exercício? |
• |
O paciente apresenta sibilos, opressão torácica ou tosse após exposição a alérgenos ou poluentes? |
• |
Quando de resfriados, manifesta sinais de bronquite, cuja resolução é maior do que dez dias? |
• |
Os sintomas melhoram com tratamento antiasmático apropriado? |
A avaliação de um paciente com suspeita de asma fundamenta-se em uma anamnese completa, incluindo um histórico ambiental detalhado, com a descrição dos potenciais desencadeantes das crises. A maioria dos especialistas em asma acredita que a história do paciente representa a parte mais importante da avaliação. A abordagem para se obter uma história detalhada, em crianças ou adultos com suspeita de asma, pode ser feita através de um questionário modificado do primeiro Expert Panel Report: Guidelines for the Diagnosis and Management of Asthma, editado pelo National Institutes of Health dos EUA1 ( Tabela 2: Anamnese Dirigida na Asma). Tabela 2: Anamnese Dirigida na Asma).
As quatro manifestações clínicas mais importantes da asma são os sibilos, a dispneia, a tosse (especialmente em crianças) e a sensação de opressão torácica.
A asma é a causa mais comum de episódios recorrentes de tosse e sibilos em adultos e crianças, embora nem tudo que sibile seja asma. Várias doenças podem causar sibilos como a insuficiência ventricular esquerda, a doença pulmonar obstrutiva crônica, a obstrução laríngea induzível ou as obstruções brônquicas localizadas. Nas crianças, fibrose cística, bronquiolite aguda viral, bronquiomalácia, estenoses brônquicas ou traqueais, anéis vasculares e aspiração de corpo estranho podem cursar com sibilos.
 Os sibilos são sons adventícios contínuos polifônicos, de caráter musical, predominantemente expiratórios na asma, produzidos pela aceleração e turbilhonamento do ar nas vias aéreas estreitadas, gerando oscilações de suas paredes.2,3 Os sibilos são sons adventícios contínuos polifônicos, de caráter musical, predominantemente expiratórios na asma, produzidos pela aceleração e turbilhonamento do ar nas vias aéreas estreitadas, gerando oscilações de suas paredes.2,3
A obstrução é mais grave, quando da associação de sibilos inspiratórios e expiratórios.4 A ausência de sibilos em um paciente asmático sinaliza como uma advertência de muita gravidade, sugerindo que os fluxos aéreos são tão baixos que não geram oscilações de parede brônquica, não determinando portanto manifestação acústica. Em outro extremo, os sibilos produzidos através de uma forte expiração forçada não se correlacionam com o grau de obstrução ou com a hiper-responsividade brônquicas.
O mecanismo da dispneia ainda não é de todo conhecido. Ocorre devido ao esforço necessário para a manutenção da adequada ventilação. Acredita-se que a dispneia seja decorrente da atividade tônica sustentada da musculatura inspiratória.5 Vários fatores aumentam a carga dos músculos inspiratórios que geram tensão para vencer o aumento da resistência que acompanha o broncospasmo. Quando ocorre hiperinsuflação, os músculos inspiratórios tornam-se mais curtos e por conseguinte menos eficientes na geração de força.
A respiração a altos volumes pulmonares (hiperinsuflação) modifica o raio de curvatura e posição do diafragma, colocando-o em desvantagem mecânica no início da inspiração, representando uma carga adicional a ser vencida pela musculatura, aumentando o trabalho inspiratório. A altos volumes a complacência do sistema respiratório diminui (o trabalho elástico da respiração está aumentado devido à redução da complacência do sistema) e a pressão positiva de final de expiração (PEEP intrínseca (PEEPi), também conhecida como auto-PEEP) impõe um limiar de carga inspiratória que deve ser superado antes que ocorra fluxo inspiratório. Nos indivíduos normais, fisiologicamente ao final de uma expiração normal, a pressão dentro das vias aéreas e alvéolos é igual à atmosférica, resultando em ausência de fluxo, enquanto que na circunstância de auto-PEEP a pressão excede a atmosférica. Muitos pacientes utilizam a musculatura expiratória para auxiliar a expiração, o que paradoxalmente determina uma piora, produzindo colapso das vias aéreas. A atividade muscular inspiratória pode também persistir durante a expiração, o que contribui para aumentar o trabalho respiratório.
A tosse (geralmente não produtiva) é quase que constante na asma, podendo por vezes ser sua única manifestação. Geralmente é pior à noite e após grandes esforços.
Acredita-se que a tosse seja decorrente do aumento da resistência ao fluxo nas vias aéreas centrais, onde os receptores da tosse são mais abundantes. McFadden6 descreveu dois grupos de pacientes asmáticos, o primeiro só com tosse e o outro com dispneia aos esforços. No grupo da tosse, a obstrução era principalmente em grandes vias aéreas, enquanto que no grupo cujo sintoma dominante era a dispneia ocorria obstrução em pequenas vias aéreas, onde os receptores de tosse são mais raros.
A sensação de opressão torácica, ou constrição, provém da estimulação de receptores vagais nas vias aéreas.7
Ao exame físico detectamos à inspeção e à palpação:

● Tiragem intercostal – retração inspiratória dos espaços intercostais, fossa supraesternal, regiões supraclaviculares e subcostais devido à obstrução (veja o vídeo)
● Utilização da musculatura acessória, principalmente nas grandes dispneias, mobilizando os músculos inspiratórios auxiliares como os esternocleidomastóideos e escalenos
● Tempo expiratório forçado, prolongando a expiração ao mesmo tempo em que aperta os lábios, deixando apenas uma pequena fenda central na comissura labial (posição de "assovio")
● Taquicardia
● Pulso paradoxal (PP) – consiste na diminuição acentuada da amplitude do pulso e até mesmo o seu desaparecimento, associado a uma diferença de pressão sistólica entre a inspiração e a expiração. Na inspiração em pessoas normais a pressão arterial sistólica diminui > 10 mm Hg. Este aumento na variabilidade da pressão intratorácica influencia o retorno venoso e por isso afeta o débito cardíaco e a pressão de ejeção do ventrículo esquerdo. Na asma aguda a pressão pleural é muito negativa na inspiração, ocorrendo grande redução na pressão intratorácica (-30 / -20 mm Hg). Mecanismos relacionados a estas grandes oscilações na pressão pleural foram propostos para explicar o pulso paradoxal, afetando a pressão arterial sistólica: por ação direta (transmissão passiva ao longo da árvore arterial) e indireta (diminuição do débito cardíaco ventricular esquerdo). O pulso paradoxal pode ser medido com o esfigmomanômetro, à beira do leito. O valor normal do PP é 10 mm Hg. Um valor > 25 mm Hg em adultos indica asma severa. Este valor para as crianças na asma severa varia de 20–40 mm Hg. A ausência de elevação no PP pode significar agravamento, pois à medida que a insuficiência respiratória progride ocorre diminuição do esforço inspiratório por fadiga muscular e as oscilações na pressão intratorácica podem ser menores.
Na Tabela 1 relacionamos a frequência dos sintomas na asma.8
Tabela 1 – Frequência dos Sintomas Respiratórios em uma População de 204 Pacientes Asmáticos
Sintomas |
Frequência (%) |
| • Sibilo isolado |
75 |
| • Sibilo com dispneia |
65 |
| • Dispneia aos esforços |
66 |
| • Dispneia sem virose |
60 |
| • Aperto torácico noturno |
48 |
| • Tosse noturna |
46 |
| • Dispneia noturna |
43 |
| • Expectoração crônica |
22 |
| • Tosse crônica |
18 |
Estudos epidemiológicos demonstram a alta frequência da associação entre asma e rinite. A associação existe em pacientes atópicos, e também naqueles com asma intrínseca, asma por aspirina e asma ocupacional. Em pacientes atópicos os sintomas nasais são aqueles da rinite alérgica, enquanto que nos não atópicos a polipose nasosinusal é a manifestação dominante.
O paciente que em vigência de asma aguda apresente dor torácica do tipo pleurítica, com dispneia grave, cianose e taquipneia, deve ser radiografado para avaliar a presença de pneumotórax. O pneumomediastino decorrente da hiperinsuflação pulmonar com ruptura alveolar no espaço intersticial, com dissecção central pelo ar (efeito Macklin) e o enfisema subcutâneo envolvendo a região cervical são raros, porém mais frequentes do que o pneumotórax ( Pneumomediastino e Asma:: Apresentação de Caso). Pneumomediastino e Asma:: Apresentação de Caso).
A radiografia de tórax tem papel limitado no diagnóstico da asma. É frequentemente normal (> 80%), mesmo durante a crise aguda, e quando anormal, os achados são inespecíficos, como a hiperinsuflação e o espessamento da parede brônquica. Existem duas indicações principais para a execução da radiografia: 1) para excluir outras condições que causam sibilos, como insuficiência cardíaca (principalmente na criança), corpo estranho, tumor etc. e 2) para identificar complicações como o pneumotórax e o pneumomediastino.
Pickup et al.9 efetuaram um estudo retrospectivo avaliando as manifestações radiológicas de 1.016 adultos hospitalizados com asma aguda em um período de quatro anos. As manifestações radiográficas foram classificadas em cinco grupos: (I) normal, 536 pacientes (52,9%); (II) achados compatíveis com doença pulmonar obstrutiva, 323 pacientes (31,8%); (III) complicações da asma incluindo infecção, atelectasias, um caso de pneumomediastino e um caso de pneumotórax, 83 pacientes (8,2%); (IV) achados incidentais sem importância, 6 casos (0,6%); e (V) achados incidentais importantes incluindo tuberculose, insuficiência cardíaca, neoplasia brônquica, 68 casos (6,7%). Concluíram que anormalidades radiológicas importantes foram encontradas em somente 15% dos casos. Pneumotórax e pneumomediastino, complicações raras porém potencialmente fatais, ocorreram em 0,15–0,2%.
A tomografia computadorizada do tórax de alta resolução (TCAR) tem permitido a visualização detalhada das vias aéreas, o que não ocorre na radiografia simples. Os achados mais comuns são o espessamento da parede brônquica, redução de sua luz, dilatação brônquica (bronquiectasias), opacidades centrolobulares e áreas de aprisionamento aéreo ("air trapping").10 A prevalência de espessamento brônquico na TCAR em pacientes com asma relatada por vários autores varia de 44 a 92%.11-14 Um estudo de Park et al.,12 comparando pacientes asmáticos e controles saudáveis, demonstrou que o espessamento das paredes brônquicas se correlaciona com o grau de obstrução, sendo a parede brônquica significativamente mais espessada em asmáticos do que em controles sem a doença.15 A intensidade do aprisionamento aéreo também se correlaciona com a gravidade da asma, embora a TCAR seja de valor limitado na distinção entre pacientes asmáticos com obstrução leve e indivíduos saudáveis.12
A bronquiectasia observada em pacientes com asma não complicada geralmente é cilíndrica e a relação diâmetro broncoarterial é inferior a 1,5.14,16
A TC expiratória com avaliação quantitativa é capaz de distinguir asmáticos com aprisionamento aéreo de indivíduos sem obstrução, ocorrendo correlação entre o grau de aprisionamento aéreo e a intensidade da limitação ao fluxo aéreo.17
A TCAR pode também auxiliar no diagnóstico diferencial entre a asma e a DPOC, pois a TCAR é mais sensível do que o estudo tradicional radiológico do tórax, demonstrando melhor o enfisema, as anormalidades das grandes vias aéreas como as bronquiectasias, assim como as alterações das pequenas vias aéreas tais como as bronquíoloectasias. (Tabela 2 ).18,19
Tabela 2 – HRCT em Pacientes com Asma e DPOC18,19
|
Asma Leve/Persistente |
|
DPOC |
Normais |
| Espessamento Brônquico |
++ |
+++ |
+ |
– |
| Enfisema |
+ |
++ |
+++ |
– |
| Bronquiectasias |
+ |
++ |
– |
– |
 As imagens das vias aéreas por ressonância magnética (RM) dinâmica através do hélio-3 hiperpolarizado (H3He) (Figura 1) têm sido obtidas utilizando a técnica de fast gradient-echo pulse sequence durante a inalação.20 As imagens dinâmicas resultantes demonstram maior grau de contraste diferencial, permitindo que as vias aéreas distais sejam nitidamente observadas, assim como a periferia pulmonar, diferente daquilo que ocorre com as imagens estáticas obtidas pela RM através do hélio-3 hiperpolarizado, nas quais só a periferia pulmonar é estudada. Com esta técnica as vias aéreas acima da sétima geração brônquica, até lóbulo pulmonar podem ser visualizadas. Nas doenças pulmonares como a asma, enfisema e a bronquiolite obliterante, esta técnica fornece uma avaliação quantitativa do grau de oclusão das vias aéreas assim como determina as regiões alveolares não ventiladas. Essa modalidade de imagem não invasiva oferece entendimento sobre a heterogeneidade da ventilação,21,22 que se mostrou ser um determinante independente da hiper-responsividade das vias aéreas e um bom preditor da frequência de exacerbações.23,24 As informações da obstrução ao fluxo aéreo e função pulmonar regional são obtidas por meio de exames tridimensionais rapidamente adquiridos sem exposição à radiação das técnicas tradicionais.25,26 As imagens das vias aéreas por ressonância magnética (RM) dinâmica através do hélio-3 hiperpolarizado (H3He) (Figura 1) têm sido obtidas utilizando a técnica de fast gradient-echo pulse sequence durante a inalação.20 As imagens dinâmicas resultantes demonstram maior grau de contraste diferencial, permitindo que as vias aéreas distais sejam nitidamente observadas, assim como a periferia pulmonar, diferente daquilo que ocorre com as imagens estáticas obtidas pela RM através do hélio-3 hiperpolarizado, nas quais só a periferia pulmonar é estudada. Com esta técnica as vias aéreas acima da sétima geração brônquica, até lóbulo pulmonar podem ser visualizadas. Nas doenças pulmonares como a asma, enfisema e a bronquiolite obliterante, esta técnica fornece uma avaliação quantitativa do grau de oclusão das vias aéreas assim como determina as regiões alveolares não ventiladas. Essa modalidade de imagem não invasiva oferece entendimento sobre a heterogeneidade da ventilação,21,22 que se mostrou ser um determinante independente da hiper-responsividade das vias aéreas e um bom preditor da frequência de exacerbações.23,24 As informações da obstrução ao fluxo aéreo e função pulmonar regional são obtidas por meio de exames tridimensionais rapidamente adquiridos sem exposição à radiação das técnicas tradicionais.25,26
Em capítulo próprio —  Fisiopatologia — são abordados em detalhes, os estudos laboratoriais que avaliam a obstrução brônquica, testes que contribuem para o diagnóstico e acompanhamento da doença. Não existe um teste único para confirmar o diagnóstico de asma. Dentre eles: as provas de função respiratória como a espirometria, a curva fluxo-volume completa – inspiratória e expiratória, a pletismografia, o pico de fluxo expiratório (PFE), os testes de broncoprovocação e a avaliação da concentração fracionada exalada de óxido nítrico exalado (FeNO). Fisiopatologia — são abordados em detalhes, os estudos laboratoriais que avaliam a obstrução brônquica, testes que contribuem para o diagnóstico e acompanhamento da doença. Não existe um teste único para confirmar o diagnóstico de asma. Dentre eles: as provas de função respiratória como a espirometria, a curva fluxo-volume completa – inspiratória e expiratória, a pletismografia, o pico de fluxo expiratório (PFE), os testes de broncoprovocação e a avaliação da concentração fracionada exalada de óxido nítrico exalado (FeNO).
Entretanto, como este é um capítulo sobre o diagnóstico de asma brônquica, para a sua confirmação, a limitação expiratória variável ao fluxo aéreo será abordada de forma sucinta.27
Hoje, a expressão "limitação variável do fluxo de ar expiratório" foi substituída por
"fluxo aéreo expiratório variável", sendo que a limitação ao fluxo de ar não necessita estar obrigatoriamente presente na ocasião do diagnóstico.
A excessiva variabilidade na função pulmonar e a limitação podem ser detectadas através da espirometria e pelo pico de fluxo expiratório (PFE):
A confirmação se estabelece usualmente através da espirometria da qual se obtém duas importantes medidas para a avaliação do fluxo aéreo expiratório variável: a Capacidade Vital Forçada (CVF) e o Volume Expiratório Forçado no primeiro segundo (VEF1), que são os medidas da função pulmonar mais confiáveis (reproduzíveis e responsivas). O diagnóstico se estabelece pela redução da relação VEF1/CVF, que é determinada pela redução percentual do VEF1 em relação ao seu valor teórico. Um VEF1 diminuído pode
ser encontrado em várias outras doenças pulmonares (ou por má técnica de execução na espirometria), mas uma relação mais baixa do VEF1 para a CVF (VEF1/CVF), em comparação com o limite inferior de referência, indica
fluxo de ar expiratório variável.
Em casos graves, a CVF pode estar reduzida devido ao aprisionamento de ar nos pulmões, refletindo a gravidade da obstrução.
■ Teste positivo de reversibilidade (responsividade) ao broncodilatador (BD)
Em um paciente com história sugestiva de asma o diagnóstico de asma é validado por aumento do VEF1 cerca de 15 minutos após a inalação de broncodilatador de ação rápida (SABA – short-acting-ß2agonist), como p. ex. 200–400 mcg de salbutamol.27,28
Adultos/adolescentes: aumento de VEF1 ou CVF de ≥12% e ≥200 ml do valor pré-broncodilatador basal (certeza se o aumento for ≥15% e ≥400 ml); ou aumento do PFE ≥20% se não for possível efetuar a espirometria.
Crianças: aumento do VEF1 acima de ≥12% do previsto ou PFE ≥20% se não for possível efetuar a espirometria.
➢ Como investigar pacientes que já recebem medicação de manutenção regular para o diagnóstico de asma?
Em pacientes recebendo medicação de controle com CI como monoterapia ou em combinação com LABA, a demonstração de obstrução variável das vias aéreas pode ser algo complexo. Enquando a influência do LABA desaparece em poucos dias, o uso de CI a longo prazo pode reduzir a responsividade das vias aéreas e influenciar no calibre das vias aéreas por mais tempo.29,30 Para pacientes sob tratamento de manutenção, a GINA recomenda fazer o diagnóstico pelos critérios clássicos de teste de reversibilidade ou teste de broncoprovocação (TBP), sendo que para este último, menos rigoroso, aceitando uma PC20 <16 mg/ml como critério diagnóstico válido. Em pacientes com teste de broncodilatação negativo (VEF1 <12% ou <200 ml) e TBP negativo utilizando cloreto de metacolina (PC20 <16 mg/ml), o tratamento de manutenção com CI é gradualmente reduzido e se os sintomas não piorarem, nem ocorrer declínio significativo na espirometria ou no monitoramento do PFE, um TBP poderá ser repetido.29,31
■ Variabilidade excessiva no PFE para diagnóstico
de fluxo aéreo expiratório variável – duas vezes ao dia durante 2 semanas
Adultos: variabilidade diurna média diária do PFE >10%.
Crianças: variabilidade diurna média diária do PFE >13%.
A variabilidade do pico de fluxo diurno é calculada a partir de dois conjuntos de leituras diárias do PFE (o mais alto do dia menos o mais baixo do dia) dividido por (média do mais alto e mais baixo do dia), em média ao longo de uma semana. Para cada medição do PFE, utilize a mais alta das três medições.

Obs: Para a avaliação da variabilidade do PFE o mesmo medidor deve ser utilizado para efetuar todas as leituras, pois a variação entre diferentes medidores de PFE pode chegar a 20%.
■ Melhora significativa da função pulmonar após 4 semanas de tratamento anti-inflamatório
O diagnóstico de asma também pode ser confirmado se houver melhora clinicamente significativa no VEF1 >12% e >200 ml ou no PFE em >20% após 4 semanas de tratamento com CI, sem infecções respiratórias.
■ Teste de Provocação ao Estímulo do Exercício – Positivo
Adultos: queda no VEF1 >10% e >200 ml do basal.
Crianças: queda no VEF1 >12% do teórico, ou PFE >15%.
■ Teste de Broncoprovocação – Positivo — usualmente feito somente em adultos
Queda do VEF1 do basal ≥20% com doses estandardizadas de metacolina ou histamina, ou ≥15% com hiperventilação estandardizada, solução salina hipertônica ou provocação com manitol.
■ Variação excessiva na Função Respiratória entre consultas (boa especificidade, porém má sensibilidade)
Adultos: variação no VEF1 >12% e >200 ml entre visitas, sem relato de infecções respiratórias.
Crianças: variação no VEF1 >12% ou PFE >15% entre consultas (pode incluir infecções respiratórias).
A capnografia é uma técnica que fornece a pressão parcial do CO2 expirado durante cada ciclo respiratório. O capnógrafo fornece um parâmetro numérico e permite a visualização de uma imagem gráfica durante o ciclo respiratório. Este teste exibe a elevação do CO2 durante a fase final da expiração do gás alveolar e o ângulo "Q" entre o início da ascensão expiratória rápida do CO2 e o plateau alveolar. Este ângulo em indivíduos normais está sempre próximo aos 90º. Na asma, a obstrução das vias aéreas e o aprisionamento aéreo determinam alterações na relação ventilação/perfusão, com retardo na mistura dos gases alveolar e do espaço morto, resultando em uma ascensão lenta do CO2 expirado, com aumento do ângulo "Q" e com plateau alveolar mais extenso (Figura 2). A capnografia se correlaciona com a espirometria em pacientes adultos com crises de asma, sendo um parâmetro bastante reprodutível.32-35
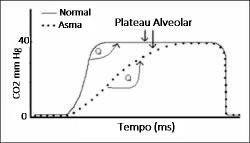 
 |
E1 – fase inaparente, ar expirado do espaço morto anatômico
E2 – ascensão quase que vertical (mistura gasosa)
Ângulo "Q" – próximo a 90º, bem delimitado
E3 – plateau expiratório quase que horizontal (ar alveolar)
R – pico tele-expiratório (PetCO2) próximo da PACO2 e da PaCO2
I1 – queda vertical (início da inspiração seguinte) |
Outros métodos complementares para o diagnóstico, investigação e avaliação do diagnóstico diferencial da asma incluem:
• Eosinófilos na sangue — aramente excede 300 por mm3, mesmo nos casos mais severos. Um valor elevado na eosinofilia fortalece a suspeita de asma e deve se utilizado em conjunto com outros testes para apoiar o adiagnóstico de asma.
• Testes alérgicos cutâneos — utilizados em pacientes com diagnóstico confirmado de asma e indicado para fenotipar a doença, diferenciando entre asma alérgica e não alérgica. A presença de atopia aumenta a probabilidade de o paciente com sintomas respiratórios apresentar asma alérgica, mas isso não é específico para asma nem está presente em todos os fenótipos da asma.
Para se confirmar o diagnóstico de alergia é preciso confirmar a presença de IgE específica para determinados alérgenos. A pesquisa é feita in vivo através de testes cutâneos de leitura imediata como o prick test ou teste de puntura na pele com alérgenos ambientais comuns. É um teste de execução simples e rápida e quando realizado por profissional experiente, com extratos padronizados, é barato e apresenta alta sensibilidade.36
• Escarro induzido — técnica utlilizada atualmente em pesquisas, com potencial aplicabilidade para propósitos diagnósticos na asma, DPOC e tosse crônica. É uma técnica não invasiva, um procedimento relativamente fácil para a sua obtenção e que permite a detecção da inflamação eosinofílica das vias aéreas, um achado constante nas biópsias brônquicas de pacientes com asma, mesmo nas de leve intensidade. A mesma técnica permite a detecção de certos mediadores que participam do processo inflamatório. Na prática, é um método limitado a centros especializados.37
• Dosagem da IgE total — cerca de metade dos pacientes alérgicos terão uma IgE total dentro da faixa normal, portanto, o valor preditivo do exame é bastante limitado. Entretanto, está frequentemente elevada na asma, ressaltando-se que valores muito altos podem sugerir a aspergilose broncopulmonar alérgica (ABPA). Outras causas não alérgicas podem determinar elevação da IgE como as parasitoses, as doenças do tecido conjuntivo e as autoimunes. Deve ser ressaltado que a medida da IgE total no soro não tem valor como teste diagnóstico para atopia. Reiterando, uma IgE total elevada não prova que os sintomas de um paciente são devidos à alergia e um nível normal de IgE não exclui alergia.38
• Dosagem da IgE específica — A IgE específica é obtida pelos métodos Radio Allergo Sorbent Test (RAST) ou sistema enzimático com afinidade cromatográfica – enzyme-linked immunoassay (ELISA). A dosagem de IgE específica pode ser realizada para uma enorme variedade de alérgenos, que são agrupados de acordo com a sua natureza, para facilitar a investigação. Os alérgenos podem ser solicitados individualmente ou em painéis (proteínas animais, inalantes – epitélio/ insetos/ poeira/ gramíneas, drogas, fungos, ocupacionais etc.). A principal limitação deste método para acessar o status alérgico é o de que um teste positivo não significa necessariamente que haja doença, pois certos indivíduos têm anticorpos IgE específicos sem manifestar qualquer sintoma de alergia.
Nos últimos 48 anos, o ensaio RAST evoluiu, substituindo anticorpos radiomarcados por anticorpos IgE anti-humanos conjugados com enzimas. Embora ainda chamado de RAST, os ensaios atuais não usam etiquetas radioativas. A automação permitiu análises mais rápidas de múltiplos alérgenos em múltiplas amostras, aumentando sensibilidade, especificidade e reprodutibilidade. Em 2009, o Clinical Laboratory Standards Institute propôs o uso de uma unidade comum, kUA/L, para relatar resultados de IgE específica para alérgenos, calibrada conforme normas da OMS.38-40
• Dosagem da Alfa-1 Antitripsina (AAT) — Recomendada pela Organização Mundial da Saúde, Sociedade Americana de Tórax e Sociedade Europeia de Respiração para todos os pacientes com asma de difícil controle, com limitação crônica ao fluxo de ar, após tratamento agressivo. Para diagnóstico diferencial com enfisema pulmonar por deficiência genética da AAT.
• Detecção da concentração fracionada de óxido nítrico exalado (FeNO) — Um aumento na FeNO tem sido descrito em pacientes com asma, incluindo aqueles com asma leve. Os níveis de FeNO são proporcionais à inflamação brônquica, sendo que o tratamento com drogas anti-inflamatórias, como os corticoides por inalação, determina reduções do NO no ar expirado. Deve ser salientado, para fins de diagnóstico diferencial, que um aumento da FeNO pode ser encontrado em outras doenças inflamatórias como a sinusite, as inflamações virais do trato respiratório superior e na rejeição que ocorre no transplante pulmonar.41-44 Por outro lado, a FeNO não se eleva na DPOC nem na fibrose cística. Os níveis de FeNO são mais baixos em fumantes do que em não fumantes.45 Nos últimos anos várias publicações têm destacado a FeNO como um valioso instrumento diagnóstico da asma.46-50
.
• TC dos seios da face — o teste mais utilizado na investigação das vias aéreas superiores, capaz de diagnosticar a sinusite (Figura 3), a polipose sinonasal e nasal, que podem estar associadas à asma;
• Broncofibroscopia — que deve ser utilizada com cautela. É um exame muito útil para confirmar a disfunção das cordas vocais. Indicada também quando de sibilância monofônica, principalmente em fumantes.
• Avaliação do refluxo gastresofágico através de EDA, monitorização do pH esofagiano, cintilografia esofagiana noturna seguida de cintilografia matinal e ultrassonografia.
• Marcadores de inflamação: contagem de eosinófilos no sangue periférico, dosagem da ECP (proteína catiônica eosinofílica) no sangue, eosinófilos no escarro induzido, níveis de ECP no escarro, óxido nítrico exalado, excreção urinária do leucotrieno E4.
* Dr. Arcot Chandrasekhar da Loyola University de Chicago - USA, o arquivo de som com a ausculta característica da asma. Mais sons pulmonares estão no site Auscultation of Lungs .
** Dr. Chris O'Callaghan da Faculty of Medicine Leicester Royal Infirmary & Dept of Child Health e Dr Wendy Stannard do Institute of Lung Health, University of Leicester, o vídeo retirado do CD Paediatric Respiratory Examination CD-ROM da BMJ.
Referências
01.National Asthma Education and Prevention Program. Expert Panel Report: Guidelines for the Diagnosis and Management of Asthma. National Institutes fo Health pub nº 91-3642. Bethesda, MD, 1991.
02.Bohadana AB. Sons pulmonares. J Pneumol 1984; 10:101-9.
03.Forgacs P. Lung Sounds . London, Baililière Tindall, 1978.
04.Shim CS, Williams MH. Relationship of wheezing to the severity of obstruction in asthma. Arch Intern Med 1983; 143:890-2.
05.Muller N, et al. Tonic inspiratory muscle activity as a cause of hyperinflation in asthma. J Appl Physiol 1981; 50:279-82.
06.McFadden ER Jr. Exertional dyspnea and cough as preludes to acute attacks of bronchial asthma. N Engl J Med 1975; 292:555-9.
07.Schwartzstein R, Lilly J, Israel E, et al. Breathlessness of asthma differs from that of external resistive loading. Am Rev Respir Dis 1991; 143:Suppl:A596, Abstract.
08.Sistek D, Tschopp JM, Schindler C et al . Preditive symptoms to diagnose current asthma. Eur Respir J 1998; 440 Suppl 28:2851.
09.Pickup CM, Nee PA, Randall PE. Radiographic features in 1.016 adults admitted to hospital with acute asthma. J Accid Emerg Med 1994; 11:234-7.
10.Paganin F, Trussard V, Seneterre E, et al. Chest radiography and high resolution computed tomography of the lungs in asthma. Am Rev Respir Dis 1992; 146:1084-7.
11.Silva CI, Colby TV, Müller NL. Asthma and associated conditions: high-resolution CT and pathologic findings. AJR Am J Roentgenol 2004; 183:817-24.
12.Park CS, Muller NL, Worthy AS, et al. Airway obstruction in asthmatic and healthy individuals: Inspiratory and expiratory thin-section CT findings. Radiology 1997; 203:361-7.
13.Grenier P, Mourey-Gerosa I, Benali K, Brauner MW, Leung AN, Lenoir S, Cordeau MP, Mazoyer B. Abnormalities of the airways and lung parenchyma in asthmatics: CT observations in 50 patients and inter- and intraobserver variability. Eur Radiol 1996; 6:199-206.
14.Lynch DA, Newell JD, Tschomper BA, Cink TM, Newman LS, Bethel R. Uncomplicated asthma in adults: comparison of CT appearance of the lungs in asthmatic and healthy subjects. Radiology 1993; 188:829-833.
15.Okazawa M, Müller N, McNamara AE, Child S, Verburgt L, Paré PD. Human airway narrowing measured using high resolution computed tomography. Am J Respir Crit Care Med 1996; 154:1557-62.
16.Mitchell TA, Hamilos DL, Lynch DA, Newell JD. Distribution and severity of bronchiectasis in allergic bronchopulmonary aspergillosis (ABPA). J Asthma 2000; 37:65-72.
17.Newman KB, Lynch DA, Newman LS, Ellegood D, Newell JD Jr.
Quantitative computed tomography detects air trapping due a asthma. Chest 1994; 106:105-9.
18.McLean An, Sproule Mw, Cowan MD, Thomson NC. High resolution computed tomography in asthma. Thorax 1998; 53:308-14.
19.Webb WR. Radiology of obstructive pulmonary disease. Am J Roentgenol 1997; 169:637-47.
20.Tooker AC, MEng KSH, Erin L, Costello P, Jolesz FA, Albert MS. Distal airways in humans: Dynamic hyperpolarized 3He MR imaging—feasibility. Radiology 2003;227:575-579.
21. Svenningsen S, Kirby M, Starr D, Coxson HO, Paterson NA, McCormack DG, Parraga G. What are ventilation defects in asthma? Thorax 2014; 69:63-71.
22.Fain S, Schiebler ML, McCormack DG, Parraga G. Imaging of lung function using hyperpolarized helium-3 magnetic resonance imaging: review of current and emerging translational methods and applications. J Magn Reson Imaging 2010; 32:1398–408
23.Downie SR, Salome CM, Verbanck S, Thompson B, Berend N, King GG. Ventilation heterogeneity is a major determinant of airway hyperresponsiveness in asthma, independent of airway inflammation. Thorax 2007; 62:684–89
24.Mummy DG, Carey KJ, Evans MD, Denlinger LC, Schiebler ML, Sorkness RL, Jarjour NN, Fain SB. Ventilation defects on hyperpolarized helium-3 MRI in asthma are predictive of 2-year exacerbation frequency. J Allergy Clin Immunol 2020; 146:831-839.e6.
25.Stewart NJ, Smith LJ, Chan HF, Eaden JA, Rajaram S, Swift AJ, Weatherley ND, Biancardi A, Collier GJ, Hughes D, Klafkowski G, Johns CS, West N, Ugonna K, Bianchi SM, Lawson R, Sabroe I, Marshall H, Wild JM. Lung MRI with hyperpolarised gases: current & future clinical perspectives. Br J Radiol 2022; 95(1132):20210207.
26.Kooner HK, McIntosh MJ, Desaigoudar V, Rayment JH, Eddy RL, Driehuys B, Parraga G. Pulmonary functional MRI: Detecting the structure-function pathologies that drive asthma symptoms and quality of life. Respirology 2022; 27:114-133.
27.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention uptdated 2023. Disponível em: https://ginasthma.org Acesso em: 29 de outubro de 2023.
28.Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, Coates A, van der Grinten CP, Gustafsson P, Hankinson J, Jensen R, Johnson DC, MacIntyre N, McKay R, Miller MR, Navajas D, Pedersen OF, Wanger J. Interpretative strategies for lung function tests. Eur Respir J 2005; 26:948-68.
29.Boulet LP, Turcotte H, Prince P, Lemière C, Olivenstein R, Laprise C, Larivée P, Bégin P, Laviolette M. Benefits of low-dose inhaled fluticasone on airway response and inflammation in mild asthma. Respir Med 2009; 103:1554-63.
30.Juniper EF, Kline PA, Vanzieleghem MA, Ramsdale EH, O'Byrne PM, Hargreave FE. Effect of long-term treatment with an inhaled corticosteroid (budesonide) on airway hyperresponsiveness and clinical asthma in nonsteroid-dependent asthmatics. Am Rev Respir Dis 1990; 142:832-6.
31.Louis R, Satia I, Ojanguren I, et al. European Respiratory Society Guidelines for the Diagnosis of Asthma in Adults. Eur Respir J 2022; in press (https://doi.org/10.1183/13993003.01585-2021).
32.Abramo T, Wiebe R, Scott S, Primm P, McIntyre D, Mydler T. Non-invasive capnometry in a pediatric population with respiratory emergencies. Ped Emerg Care 1996; 12(4):252-5.
33.You B. Capnography research in asthma. Disponível na Internet via www URL: http://capno.chez.tiscali.fr/index.htm. (Arquivo capturado em 3 de junho de 2003).
34.You B. Expiratory capnography in asthma. Perspectives in the use and monitoring in children. Rev Mal Respir 1992; 9(5):547-52.
35.Evered L, Ducharme F, Davis GM, Pusic M. Can we assess asthma severity using expiratory capnography in a pediatric emergency department? CJEM 2003; 5:169-170.
36.Coelho, APC, Galvão, CES. – Testes Cutâneos de Leitura Imediata: Técnica e Interpretação de Rsultados. In: Fábio F. Morato Castro. Diagnóstico Clínico e Laboratorial em Alergia. São Paulo: Manole; 2012:19-31.
37.Pizzichini E, Pizzichini MM, Efthimiadis A, Evans S, Moris MM, Squillace D, Gleich GJ, Dolovich J, Hargreave FE. Inflammation in induced sputum: reproducibility and validity of cell and fluid-phase measurements. Am J Respir Crit Care Med 1996; 154:308-317.
38.Knight V, Ramamoorthy P, Harbeck RJ. – In vitro Laboratory Tests foir the Diagnosis of Allergy. In: Pudupakkam K Vedanthan, Harold S Nelson, Shripad N Agasne, PA Mahesh, Rohit Katial. Allergy For the Clinician. 2nd ed. Boca Raton: CRC Press; 2021:43-48.
39.Matsson FH, Robert G. Hamilton, Per N. Matsson, Debra L. Hovanec-Burns, Mark Van Cleve, Sic Chan et al. Analytical performance characteristics and clinical utility of immunological assays for human IgE antibodies of defined allergen specificities. 2nd ed. Wayne, PA: Clinical Laboratory Standards Institute 2008.
40.Hamilton RG, Franklin Adkinson N Jr. In vitro assays for the diagnosis of IgE-mediated disorders. J Allergy Clin Immunol. 2004 Aug;114(2):213-25; quiz 226.
41.Al-Ali MK, Howarth PH. Nitric oxide and the respiratory system in health and disease. Respir Med 1998; 92:701–15.
42.Silkoff PE, Caramori M, Tremblay L, et al. Exhaled nitric oxide in human lung transplantation. A noninvasive marker of acute rejection. Am J Respir Crit Care Med 1998; 15:1822–8.
43.Kharitonov S, Alving K, Barnes PJ. Exhaled and nasal nitric oxide measurements: recommendations. ERS Task Force Report. Eur Respir J 1997; 10:1683–93.
44.Kharitonov SA, Yates D, Barnes PJ. Increased nitric oxide in exhaled air of normal human subjects with upper respiratory tract infections. Eur Respir J 1995; 8:295–7.
45.Kharitonov SA, Robbins RA, Yates D, et al. Acute and chronic effects of cigarette smoking on exhaled nitric oxide. Am J Respir Crit Care Med 1995; 152:609–12.
46.Dupont LJ, Demedts MG, Verleden GM. Prospective evaluation of the validity of exhaled nitric oxide for the diagnosis of asthma. Chest 2003; 123:751–6.
47.Deykin A, Massaro AF, Drazen JM, et al. Exhaled nitric oxide as a diagnostic test for asthma. Am J Respir Crit Care Med 2003; 165:1597–601.
48.Smith AD, Cowan JO, Filsell S, et al. Diagnosing asthma. Comparisons between exhaled nitric oxide measurements and conventional tests. Am J Respir Crit Care Med 2004; 169 :473–8.
49.Dweik RA, Boggs PB, Erzurum SC, On behalf of the American Thoracic Society Committee on Interpretation of Exhaled Nitric Oxide Levels (FeNO) for Clinical Applications, et al. An official ATS clinical practice guideline: interpretation of exhaled nitric oxide levels (FeNO) for clinical applications. Am J Respir Crit Care Med 2011;184:602–15.
50.Ruggins N, Carroll W. Managing childhood asthma: clinical experience with the measurement of fractional exhaled nitric oxide (FeNO). Paediatr Child Health. 2014;24:260–3. 37.
Bukstein D, Luskin AT, Brooks EA. Exhaled nitric oxide as a tool in managing and monitoring difficult-to-treat asthma. Allergy Asthma Proc 2011; 32:185–92.
|