|
Asma
Resposta Tardia da Asma
NEUTRÓFILOS — Asma Neutrofílica
A asma é reconhecida como uma doença inflamatória alérgica, uma doença eosinofílica, com um aumento do número de eosinófilos ativados na mucosa das vias aéreas e no escarro. A inflamação do Tipo 2 alta nas vias aéreas é caracterizada pela presença de citocinas (IL-4, IL-5 e IL-13) que foram originalmente reconhecidas como sendo produzidas por células T auxiliares Tipo 2 (Th2).
A hipótese que considera o eosinófilo a célula efetora-chave da patogênese da asma apresenta alguns pontos questionáveis:
➭ A inflamação eosinofílica está presente na luz brônquica em apenas 50% dos pacientes com asma (Figura 1);1
➭ Mesmo a intensa inflamação eosinofílica da bronquite eosinofílica, esta não induz à asma;2
➭ Muitas exacerbações de asma ocorrem sem que haja eosinofilia nas vias aéreas;
➭ Ratos de laboratório deficientes em eosinófilos foram criados (knockout mouse) e esta modificação tem pouco impacto nos achados patológicos das vias aéreas, em resposta à sensibilização pela ovoalbumina.3
Na Figura 1 é apresentado um sumário da proporção de pacientes com asma eosinofílica e não eosinofílica de vários estudos da literatura compilados por Douwes et al.1 A inflamação eosinofílica está presente na luz brônquica em cerca de 50% dos pacientes com asma, na média. O perfil inflamatório da asma não eosinofílica quando analisado na maioria dos estudos parece ser muito semelhante ao descrito para a asma ocupacional, relacionado ao aumento de neutrófilo e níveis de IL-8 e consistente com a ativação de mecanismos imunes inatos, mediando o processo inflamatório em indivíduos com asma não eosinofílica.
Percentual de Asma Eosinofílica no Adulto na População |
Geral (Douwes et al. Thorax, 2002) |

Dados recentes confirmam a considerável heterogeneidade dos fenótipos da asma, sendo que vários indivíduos exibem doença brônquica caracterizada por neutrofilia no escarro. Os neutrófilos foram implicados nas exacerbações da asma induzidas por vírus,4,5 na asma severa esteroide dependente, na asma noturna,6-8 na asma em fumantes, na asma ocupacional (agentes de baixo peso molecular),9-13 nos casos de asma desencadeadas por poluentes como partículas de escapamento de diesel, ozônio ou óxido de nitrogênio,14 na asma quase-fatal e fatal15,16 e naqueles com a presença bacteriana persistente e respostas Th1 e Th17 potentes.17,18
A asma não eosinofílica pode ser observada em pacientes com asma grave, mas também em aproximadamente metade dos pacientes com asma leve a moderada.19 Em pacientes com asma leve, aqueles com inflamação neutrofílica, especialmente os sem inflamação eosinofílica coexistente, são menos propensos a ter respostas de curto prazo aos corticoides do que aqueles com inflamação eosinofílica.20
A patogênese da inflamação das vias aéreas em que predominam os neutrófilos em adultos com asma pode refletir resposta deficiente de eliminação bacteriana pelos neutrófilos observada com a idade, resultando em dano celular, hipersecreção de muco e remodelação das vias aéreas. No entanto, em crianças com asma, os neutrófilos estão menos associados às características adversas da doença e é possível que nestas os neutrófilos sejam menos patogênicos.21 Os neutrófilos estão também relacionados à asma em pacientes obesos20 e
naqueles portadores da síndrome da apneia obstrutiva do sono.22-24
O uso de contagens de neutrófilos no escarro induzido para definir a inflamação neutrofílica não é ideal porque os neutrófilos, ao contrário dos eosinófilos, são um constituinte normal das células recuperadas no escarro induzido, e o ponto de corte que sugere um aumento na contagem de neutrófilos não foi definido. A contagem de neutrófilos no escarro de indivíduos saudáveis é altamente variável, com uma média de 30 a 35%,25 oscilando na asma neutrofílica entre 40% e 76% das células do escarro.26-29 Nair et al.27 propuseram que o termo 'asma neutrofílica' deveria ser limitado aos pacientes que apresentam em pelo menos duas ocasiões contagens de neutrófilos no escarro ≥5 x10-9/L. Scheich et al.30 efetuaram estudo retrospectivo com 508 pacientes de asma nos quais realizaram a técnica de escarro induzido que foi considerada bem-sucedida, e utilizaram análise de regressão logística múltipla.
A inflamação eosinofílica foi definida por uma proporção de eosinófilos no escarro ≥ 3%, enquanto o fenótipo neutrofílico foi caracterizado por uma proporção de neutrófilos ≥ 76%." 30
Lembrar, no entanto, que enquanto pacientes com ≥ 3% de eosinófilos no escarro são considerados 'eosinofílicos', até 60% de neutrófilos no escarro também podem estar presentes.30-32
Os pacientes com asma neutrofílica são menos atópicos e geralmente apresentam níveis mais baixos da fração exalada de óxido nítrico (FeNO), geralmente < 30 partes por bilhão33 e < 300 eosinófilos/µL no sangue.
 Os neutrófilos estão presentes principalmente nos pacientes com inflamação Tipo 2 baixa – asma moderada / severa e nas exacerbações da doença. Embora o seu papel na patogênese da asma leve não tenha sido estabelecido, existem evidências circunstanciais que demonstram também a sua participação no processo inflamatório brônquico de pacientes com asma leve intermitente e persistente.29 Simpson et al.34 através de estudo por escarro induzido, analisaram os subfenótipos inflamatórios de um grupo de cerca de 93 pacientes com asma, com idade média de 42 anos (18–77 anos), VEF1 de 76% ± 20, detectaram 41% de pacientes com asma eosinofílica, 20% neutrofílica, 8% mista e 31% paucigranulocítica (Figura 2). Os neutrófilos estão presentes principalmente nos pacientes com inflamação Tipo 2 baixa – asma moderada / severa e nas exacerbações da doença. Embora o seu papel na patogênese da asma leve não tenha sido estabelecido, existem evidências circunstanciais que demonstram também a sua participação no processo inflamatório brônquico de pacientes com asma leve intermitente e persistente.29 Simpson et al.34 através de estudo por escarro induzido, analisaram os subfenótipos inflamatórios de um grupo de cerca de 93 pacientes com asma, com idade média de 42 anos (18–77 anos), VEF1 de 76% ± 20, detectaram 41% de pacientes com asma eosinofílica, 20% neutrofílica, 8% mista e 31% paucigranulocítica (Figura 2).
A única função dos neutrófilos é a sua capacidade de fagocitar e matar microrganismos, com o propósito de impedir a invasão dos tecidos pelos microrganismos. Ocorrendo a invasão, a inflamação é desencadeada através da produção e liberação de suas citocinas e quimiocinas para ativar outras células envolvidas no processo.
Os neutrófilos representam o tipo de célula imune mais abundante no sangue,
respondendo por 50 a 70% de todas as células brancas circulantes e são gerados na medula óssea sob o controle de fatores de transcrição-chave como C / EBPa (CCAAT/Enhancer-Binding Protein), PU.1, Gfi-1 (Growth Factor Independent 1 Transcriptional Repressor), e C / EBPε.35,36 A produção diária de neutrófilos em um ser humano adulto normal é extensa, oscilando em torno de 1 a 2 × 1011 células. Eles não 'residem nos tecidos saudáveis' ao contrário dos macrófagos, mas migram rapidamente para os locais onde ocorre dano tecidual e participam das defesas imunes inatas, como principal célula fagocítica e microbicida.37 Eles são reconhecidos há longa data como células imunes de vida curta (meia-vida de 6–12 h)38 especializadas em matar patógenos por meio de seu alto potencial fagocítico e da secreção de grânulos citotóxicos, uma vez recrutados aos tecidos.39
O G-CSF (Granulocyte Colony Stimulating Factor) é essencial para ajustar a produção de neutrófilos para atender às necessidades aumentadas durante as infecções, mas o G-CSF não é absolutamente necessário para a granulocitopoiese porque ratos com deleção do gene do G-CSF têm aproximadamente 25% de granulocitopoiese residual e geram totalmente neutrófilos maduros.40 A produção de neutrófilos é amplamente regulada pela taxa de apoptose de neutrófilos nos tecidos.
Uma vez liberados da medula óssea para a circulação, os neutrófilos 'vigiam' os vasos sanguíneos e navegam em direção à inflamação detectando gradientes quimiotáticos como o CXCL-8, que podem ser liberados devido à interação de padrões moleculares microbianos ou associados a danos. Durante esse processo, os neutrófilos usam sua polaridade celular, regulada por Rho Guanosina Trifosfatases (Rho GTPases), visando realizar o movimento ameboide para atingir com precisão o local da inflamação.41 A fim de permitir a migração através de matrizes extracelulares densas, os neutrófilos liberam proteinases, como a elastase de neutrófilos (EN) e a proteinase 3 (PR3), para clivar componentes da matriz extracelular, como elastina, fibronectina, vitronectina, laminina e colágeno.42
Os neutrófilos são células arredondadas com cerca de 7 micra de diâmetro e facilmente reconhecidos no esfregaço de sangue periférico  (Figura 3) pela forma de seu núcleo, motivo pelo qual recebeu a designação inexata de polinucleares, quando na verdade trata-se de um único núcleo com várias zonas estreitadas, formando pontes de substância nuclear. O citoplasma ligeiramente acidófilo é repleto de grânulos heterogêneos. Os maiores são chamados de primários ou grânulos azurófilos, são peroxidase positivos, enquanto que os menores, denominados de grânulos secundários ou grânulos específicos são peroxidase negativos. São células de vida curta, seis a oito horas, ligadas primariamente à defesa contra infecção e injúria tecidual. Devido a esta propriedade, os neutrófilos necessitam de se mover com rapidez para alcançar o sítio inflamatório, no espaço extravascular. Para isto, expressam em sua superfície receptores para um grande número de agentes quimiotáxicos. Várias proteínas de adesão foram também identificadas nos neutrófilos, dentre elas as de particular importância, as β2-integrinas LFA-1 e Mac-1 que são ligantes para a ICAM-1 e ICAM-2.43 (Figura 3) pela forma de seu núcleo, motivo pelo qual recebeu a designação inexata de polinucleares, quando na verdade trata-se de um único núcleo com várias zonas estreitadas, formando pontes de substância nuclear. O citoplasma ligeiramente acidófilo é repleto de grânulos heterogêneos. Os maiores são chamados de primários ou grânulos azurófilos, são peroxidase positivos, enquanto que os menores, denominados de grânulos secundários ou grânulos específicos são peroxidase negativos. São células de vida curta, seis a oito horas, ligadas primariamente à defesa contra infecção e injúria tecidual. Devido a esta propriedade, os neutrófilos necessitam de se mover com rapidez para alcançar o sítio inflamatório, no espaço extravascular. Para isto, expressam em sua superfície receptores para um grande número de agentes quimiotáxicos. Várias proteínas de adesão foram também identificadas nos neutrófilos, dentre elas as de particular importância, as β2-integrinas LFA-1 e Mac-1 que são ligantes para a ICAM-1 e ICAM-2.43
São duas as características dos neutrófilos quanto aos mediadores que produz:
➭ A primeira, ligada à fagocitose seguida pela morte em fagolissoma e digestão de bactérias, fungos e partículas estranhas, inclui enzimas. Para permitir a migração através de matrizes extracelulares densas, os neutrófilos liberam proteinases, como a elastase neutrofílica e a PR3, para clivar componentes da matriz extracelular, como elastina, fibronectina, vitronectina, laminina e colágeno.42 Os neutrófilos também podem exterminar fungos e bactérias por degranulação, um processo no qual os neutrófilos liberam extracelularmente Espécies Reativas de Oxigênio (ROS).42,44 Em resposta a estímulos infecciosos, os neutrófilos formam armadilhas extracelulares (NETs) para proteger o hospedeiro;38,45,46 no entanto, essas estruturas também contribuem para lesões e inflamações nos tecidos.47-49 As NETs são compostas de DNA de fita dupla (dsDNA) e proteínas de histonas modificadas, como a histona H3 citrulinada (Cit-H3), além de proteínas granulares, como elastase de neutrófilos (NE) e mieloperoxidase (MPO).50 Quando de asma grave, o aumento de neutrófilos pode intensificar a formação de NETs, em um processo conhecido como NETose.51-53 O dsDNA liberado pelas NETs ativa a exacerbação alérgica da asma induzida por rinovírus,54 enquanto a NETose induzida por doses baixas de lipopolissacarideos (LPS) estimula a inflamação alérgica das vias aéreas em resposta a alérgenos como os ácaros da poeira doméstica.55
➭ A segunda, congrega mediadores que atraem e ativam mais neutrófilos. Estes mediadores incluem mediadores lipídicos (LTB4) e citocinas (IL-1, TNF-a e IL-8/(CXCL-8), IL-6, IL-12, M-CSF e GM-CSF).
Na inflamação alérgica em humanos, o acúmulo de neutrófilos quando de provocação alérgica precede ao dos eosinófilos. Além do mais, o pico de acúmulo de neutrófilos ocorre em aproximadamente oito horas, o que corresponde ao início da fase tardia da doença. Entretanto, nenhuma relação causal entre neutrófilo e sintomas de doença alérgica ou asma até hoje foi bem estabelecida. Existe a possibilidade de que o dano tecidual causado pelos neutrófilos ativados no início do processo possa contribuir para a patogenicidade da inflamação alérgica, particularmente nas superfícies mucosas, a longo termo.
Na asma, as funções dos neutrófilos podem ser alteradas ainda mais (Figura 4).21 Pacientes com asma neutrofílica apresentam uma super-regulação sistêmica da expressão de α-defensinas e proteases de neutrófilos56 e aumento da formação de NET.57 Além disso, os neutrófilos isolados de pacientes com asma neutrofílica exibem migração aumentada, embora velocidade reduzida de fagocitose em comparação com controles saudáveis in vitro.58 Por outro lado, adultos com asma neutrofílica exibem respostas imunes inatas alteradas, como redução da síntese de interferon antiviral (IFN),50,59 deficiências anti-inflamatórias associadas à redução de galectina-3 e IL-1RA / IL-1β,60 expressão aumentada de receptores de padrão molecular associados a patógenos, como TLR-2 e TLR-4,61 expressão elevada de inflamassomas, como NLRP362 e liberação elevada de mediadores pró-inflamatórios, como CXCL-8 e IL-1β.61 Na asma neutrofílica várias células descendentes mieloides são recrutadas nas vias aéreas onde interagen para ativar células Th17 e promover a infiltração de neutrófilos.63
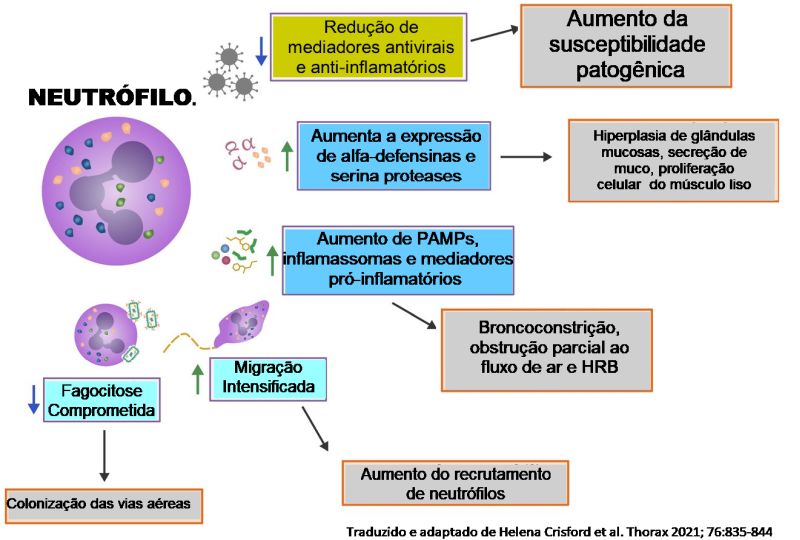
A asma neutrofílica acomete pacientes mais velhos (acima de 25 anos), com um número total de células inflamatórias elevado quando comparado ao de pacientes com padrão eosinofílico.34 É mais comum em mulheres e em pacientes não atópicos.64 O padrão de elevação de neutrófilos no escarro é mais encontrado naqueles que fumam, na poluição ambiental pelo ozônio e por matéria particulada do diesel, durante as exacerbações da doença e frequentemente durante as infecções virais que acometem o trato respiratório superior.65 Nas crianças um aumento significante de neutrófilos é detectado no escarro induzido durante as exacerbações.66,67 Esses irritantes podem causar lesões nas vias aéreas e em seguida levar à liberação de receptores do tipo toll-like (TLRs). A análise do escarro em pacientes com asma neutrofílica demonstra um aumento na expressão de receptores imunes inatos, incluindo TLR2, TLR4 e CD14, bem como citocinas pró-inflamatórias IL-8 e IL-1ß.68 Sabe-se que a ativação do TLR induz a uma mudança em direção às respostas TH1 e Th17 levando à geração de IL-8, IL-1ß, IFN-γ e TNF-a.69 IL-1ß é uma citocina imune inata típica, e um aumento na IL-1ß das vias aéreas (como resultado de exacerbações anteriores) foi associado à inflamação sistêmica (observada por um aumento na IL-6) e ao risco de futuras exacerbações, desencadeando um ciclo vicioso.70
Em crianças a neutrofilia das vias aéreas é menos frequente mas, quando ocorre, está associada às bactérias,71 e ao contrário da asma neutrofílica do adulto, a neutrofilia na asma grave pediátrica parece ter um perfil de mediadores inflamatórios diferente sem a IL-17.72,73 Os estudos em crianças pertencem às coortes de asma grave e não à doença leve a moderada.
Em adultos os neutrófilos do escarro (vias aéreas) estão associados à asma mais severa. Moore et al.74 detectaram que pacientes com mais de 60% (mediana) de neutrófilos no escarro tendiam a ser mais velhos, do sexo masculino, tinham asma de início tardio, doença pulmonar mais grave, recebiam prescrições de doses mais altas de corticoides inalados, eram mais propensos a tomar corticoide oral, tinham maior incidência de hospitalização por asma (55% vs 28%)74 e mais comorbidades, como hipertensão, osteoporose e doença do refluxo gastroesofágico.74,75
A resistência à insulina parece amplificar a associação negativa entre asma e obesidade,76 com ativação da expressão do fator de crescimento de transformação beta 1 (TGF-ß1) no epitélio brônquico estimulando a produção de tecido conjuntivo pelos fibroblastos, levando à remodelação das vias aéreas,77 o que pode afetar a neutrofilia das vias aéreas.21,76
O recrutamento dos neutrófilos nos pulmões é multifatorial e depende de mediadores quimiotáxicos de neutrófilos, como o leucotrieno B4 (LTB4); anafilotoxinas – fragmentos C3a e C5a e quimiocinas Cysteine-X-Cysteine (CXC) de células residentes das vias aéreas como a IL-8, conhecida como Cysteine-X-Cysteine Chemokine Ligand (CXCL8; GRO-a (Growth-Related Oncogene a) também denominado de CXCL1; e ENAP 78 (Epithelial-Neutrophil Activating Peptide 78) ou CXCL5. Níveis elevados de mediadores ativos dos neutrófilos, como IL-8, elastase de neutrófilos, MMP-9, uma forma de matriz de metaloproteinase-9 que mostra inibição reduzida por inibidores teciduais de metaloproteinases,69 IL-17A, LTB4, GM-CSF e TNF-a, foram detectados no sangue, no lavado broncoalveolar (LBA) e epitélio brônquico de pacientes com asma neutrofílica.78
Foi demonstrado que o número de neutrófilos aumenta em pacientes com asma grave em comparação com fenótipos de asma leve, e a inflamação neutrofílica é resistente ao corticoide.79-81 Os neutrófilos, que são a maior fonte de LTB4, estão aumentados no exalado respiratório de pacientes com asma severa.82 O leucotrieno B4 é gerado pela via da 5-lipo-oxigenase (5-LO) e atua na quimioatração dos neutrófilos, via receptor de leucotrieno B4 (BLT) expressos na superfície dos neutrófilos. Estudos em pacientes com asma grave demonstraram inflamação persistente das vias aéreas. Apesar do tratamento crônico de longo prazo com corticoide, as concentrações de LTB4 detectadas nestes pacientes estavam aumentadas no LBA, sobrenadante do escarro induzido e em tecidos quando comparadas ao grupo controle sem asma e em pacientes com asma leve / moderada.80,83
 As concentrações de IL-8 se encontram aumentadas no escarro de pacientes com asma e se correlacionam com o número de neutrófilos (Figura 5).27,34,81 A expressão do gene da IL-8 e a presença da proteína foram evidenciadas nas células epiteliais brônquicas e esta citocina pode ser induzida por infecção viral, pelo fumo, por alérgenos e poluentes aéreos. A IL-8 é um potente quimiotático e ativador de neutrófilos. Ela ativa os neutrófilos via receptor específico acoplado de baixa afinidade proteína-G (receptor para quimiocinas CXC [CXCR]-1) e também pelo receptor [CXCR]-2 e dentre suas várias atividades está a degranulação dos neutrófilos com liberação de elastase neutrofílica, lactoferrina, beta-glucoronidase e mieloperoxidase. A IL-8 também upregulate a expressão de duas integrinas (CD11b/CD18 e CD11c/CD18) durante a exocitose dos grânulos específicos.84,85 A IL-8 ativa 5-lipo-oxigenase do neutrófilo, com a formação do LTB4 e do ácido 5-hidroxieicosatetraenoico e induz à produção de PAF.86 As concentrações de IL-8 se encontram aumentadas no escarro de pacientes com asma e se correlacionam com o número de neutrófilos (Figura 5).27,34,81 A expressão do gene da IL-8 e a presença da proteína foram evidenciadas nas células epiteliais brônquicas e esta citocina pode ser induzida por infecção viral, pelo fumo, por alérgenos e poluentes aéreos. A IL-8 é um potente quimiotático e ativador de neutrófilos. Ela ativa os neutrófilos via receptor específico acoplado de baixa afinidade proteína-G (receptor para quimiocinas CXC [CXCR]-1) e também pelo receptor [CXCR]-2 e dentre suas várias atividades está a degranulação dos neutrófilos com liberação de elastase neutrofílica, lactoferrina, beta-glucoronidase e mieloperoxidase. A IL-8 também upregulate a expressão de duas integrinas (CD11b/CD18 e CD11c/CD18) durante a exocitose dos grânulos específicos.84,85 A IL-8 ativa 5-lipo-oxigenase do neutrófilo, com a formação do LTB4 e do ácido 5-hidroxieicosatetraenoico e induz à produção de PAF.86
A inflamação neutrofílica pode também ser induzida pela IL-17 liberada por um subtipo de linfócito T denominado Th17.
Foi demonstrado que as células Th17 secretam IL-17A, IL-17F e IL-22, que geralmente são resistentes aos corticoides.87 No escarro induzido de pacientes com asma, principalmente nos com maior gravidade, existe um aumento nas células Th17,88 medido através de um aumento no IL-17 mRNA (1 de 6 membros da família IL-17 de citocinas). Estes achados se correlacionam com um aumento da IL-8. A IL-17A também está aumentada no escarro de pacientes com asma muito severa.88 A IL-17A libera das células epiteliais brônquicas a IL-8, GRO-a e TNF-a que participam na orquestração da inflamação neutrofílica da asma (Figura 6). O tabagismo também está associado à inflamação neutrofílica na asma,89 derivada da ativação epitelial e macrofágica80 e a expressão aumentada de IL-17A, IL-6 e IL-8, com IL-17A se correlacionando com a IL-8 e a contagem de neutrófilos. Siew et al.91 demonstraram que a expressão de IL-17A, IL-6 e IL-8 e o número de neutrófilos foram significativamente mais elevados na mucosa brônquica de fumantes com asma em comparação com as de não fumantes.
Na asma neutrofílica o eixo IL-23-Th17 desempenha um papel crítico no recrutamento e ativação de neutrófilos.92 Em particular, a IL-23 induz infiltração neutrofílica nas vias aéreas de murinos asmáticos, levando à asma neutrofílica por meio da ativação de células Th17 e secreção de IL-17.93,94 A IL-17F, outro membro desta família, tem efeitos semelhantes sobre os neutrófilos.95 As células Th17 são reguladas pela IL-23, uma citocina IL-12-like, secretada pelas células dendríticas, porém seu papel na asma não é ainda conhecido.96 Assim, o desenvolvimento de terapêuticas direcionadas à IL-23 foi desacelerado porque os mecanismos regulatórios da IL-23 e seu papel específico na asma neutrofílica não estão claros.97 Entretanto, as células-alvo da IL-23 e seus papéis funcionais na inflamação neutrofílica precisam ser investigados. Anticorpos que bloqueiam a IL-17 e a IL-23 são efetivos contra a inflamação neutrofílica em várias outras doenças, e estão em fase de desenvolvimento para aplicação terapêutica. No entanto, nem o bloqueio do receptor A IL-17,98 nem a a inibição da IL-23, um indutor da IL-17 pelo
risankizumabe, um anticorpo monoclonal anti-IL-23, resultaram em qualquer benefício terapêutico para indivíduos com asma.99 Portanto, mais pesquisas são necessárias para entender completamente os mecanismos pelos quais a IL-17 contribui para a asma não T2 e para desenvolver novas estratégias terapêuticas eficazes para atingir a IL-17.
 Os vírus podem estimular as células epiteliais a liberar IL-8 e GRO-a. Os alérgenos podem estimular as células dendríticas a liberar IL-23, que recrutam células Th17 que secretam IL-17 que atua sobre o epitélio brônquico. As células epiteliais sob a ação da IL-17 liberam o TNF-a que torna maior a inflamação e ainda a IL-8 e o GRO-a, que recrutam mais neutrófilos para as vias aéreas. Estes, por sua vez, liberam mais IL-8 e o TGF-b (Transforming Growth Factor-b) que ativam os fibroblastos os quais determinam fibrose, participando do processo de remodelamento brônquico; liberam a elastase do neutrófilo e a matrix metaloproteinase (MMP)-9 que estimulam a secreção de muco pelas células caliciformes (Figura 6).100 Os vírus podem estimular as células epiteliais a liberar IL-8 e GRO-a. Os alérgenos podem estimular as células dendríticas a liberar IL-23, que recrutam células Th17 que secretam IL-17 que atua sobre o epitélio brônquico. As células epiteliais sob a ação da IL-17 liberam o TNF-a que torna maior a inflamação e ainda a IL-8 e o GRO-a, que recrutam mais neutrófilos para as vias aéreas. Estes, por sua vez, liberam mais IL-8 e o TGF-b (Transforming Growth Factor-b) que ativam os fibroblastos os quais determinam fibrose, participando do processo de remodelamento brônquico; liberam a elastase do neutrófilo e a matrix metaloproteinase (MMP)-9 que estimulam a secreção de muco pelas células caliciformes (Figura 6).100
O recrutamento de neutrófilos na asma severa envolve ainda a interação com moléculas de adesão expressas no endotélio dos vasos pulmonares e brônquicos, dentre elas, a ICAM-1 e a E-selectina, que interagem com selectinas expressas nas superfícies dos neutrófilos.100
Os neutrófilos são células de vida curta nos tecidos e sua vitalidade nos pulmões é garantida por fatores de crescimento como o GM-CSF e o G-CSF. O neutrófilo também promove a degranulação das células caliciformes e produz MUC-5mRNA.
O aumento no número de neutrófilos no escarro é um parâmetro de perda de controle no tratamento da asma, ou agravamento da doença, indicando a necessidade de busca de novos medicamentos para tratamento. Há longo tempo sabemos da ineficiência dos corticoides na asma neutrofílica, mesmo quando de altas doses, ao contrário do que se observa na asma alérgica eosinofílica. O aumento de neutrófilos nos pacientes com asma severa não parece ser devido às altas doses de corticoides que fazem uso, apesar de ser bem conhecida a ação inibitória desta droga na apoptose dos neutrófilos.87 Um número elevado de neutrófilos também é encontrado em pacientes com asma que não são tratados com corticoides.101,102 Embora os corticoides orais possam induzir neutrofilia das vias aéreas, isso não foi demonstrado de forma consistente com os corticoides inalados.102
A colonização bacteriana nas vias aéreas de pacientes com asma severa pode colaborar para a asma neutrofílica103,104 e tem sido associada à deficiente fagocitose bacteriana e à apoptose celular por macrófagos.105,106 Esses processos podem contribuir para maior estresse oxidativo nas vias aéreas e consequente insensibilidade aos corticoides em pacientes com asma grave. O tratamento com corticoides orais pode concorrer para a neutrofilia em algum grau.107,108 As células imunes Th17 foram implicadas como fator para a neutrofilia na inflamação, na produção de muco, na resistência aos corticoides, na indução da hiper-responsividade e na fibrose subepitelial como mostram estudos na asma grave.104,109
 Estudos evidenciaram a atuação dos broncodilatadores de longa ação neste tipo de inflamação, podendo ser benéfico na prevenção das exacerbações da asma.110 O formoterol reduziu significativamente os níveis de IL-8 e o número de neutrófilos no escarro de pacientes com asma quando comparados aos do grupo placebo (Figura 7). O formoterol inibe a adesão de neutrófilos em vênulas pós-capilares de vias aéreas de ratos,111 atenuando desta forma a inflamação neutrofílica. Um outro estudo demonstrou que o salmeterol reduz de forma significante o número de neutrófilos e a quantidade de mieloperoxidase em fragmentos de biópsia brônquica de pacientes com asma.112 Provavelmente, talvez seja este um dos motivos de sua boa atuação na asma moderada e severa persistente, quando associados aos corticoides por inalação. Anticorpos que bloqueiam a IL-17, a IL-23 e antagonistas [CXCR]2 são capazes de reduzir o influxo de neutrófilos e poderão se constituir em novas estratégias para o tratamento. Estudos evidenciaram a atuação dos broncodilatadores de longa ação neste tipo de inflamação, podendo ser benéfico na prevenção das exacerbações da asma.110 O formoterol reduziu significativamente os níveis de IL-8 e o número de neutrófilos no escarro de pacientes com asma quando comparados aos do grupo placebo (Figura 7). O formoterol inibe a adesão de neutrófilos em vênulas pós-capilares de vias aéreas de ratos,111 atenuando desta forma a inflamação neutrofílica. Um outro estudo demonstrou que o salmeterol reduz de forma significante o número de neutrófilos e a quantidade de mieloperoxidase em fragmentos de biópsia brônquica de pacientes com asma.112 Provavelmente, talvez seja este um dos motivos de sua boa atuação na asma moderada e severa persistente, quando associados aos corticoides por inalação. Anticorpos que bloqueiam a IL-17, a IL-23 e antagonistas [CXCR]2 são capazes de reduzir o influxo de neutrófilos e poderão se constituir em novas estratégias para o tratamento.
Os macrolídeos são drogas passíveis de utilização no tratamento da inflamação não eosinofílica das vias aéreas, particularmente na asma neutrofílica refratária. Simpson et al.113 através de um estudo duplo-cego, randomizado, placebo controlado, em pacientes com asma refratária, demonstraram que a claritromicina, na dose de 500 mg duas vezes ao dia por oito semanas, reduzia significativamente a IL-8 das vias aéreas e o número de neutrófilos, com melhora dos índices de qualidade de vida. Reduções nas concentrações de MMP-9 e elastase também ocorreram, sugerindo uma downregulation na ativação neutrofílica e na liberação de mediadores. Gibson et al.114 publicaram outro estudo duplo-cego, randomizado, placebo controlado, avaliando o efeito da azitromicina nas exacerbações da asma e na qualidade de vida em adultos com asma persistente malcontrolada, conhecido como estudo AMAZES
(Asthma and Macrolides: Azithromycin Efficacy and Safety). Trata-se de um ensaio clínico de mais de 48 semanas com amostra de 420 pacientes, utilizando 500 mg duas vezes por semana. Os resultados do estudo AMAZES apontam que a azitromicina é um tratamento potencial para pacientes com asma não eosinofílica, para os quais há um limitado arsenal terapêutico. porém, houve melhora na qualidade de vida relacionada à asma. O mecanismo de ação pode ser devido às ações antibacterianas ou anti-inflamatórias, que incluem inibição de NF-kB e outros fatores de transcrição, bem como redução na migração ou função de neutrófilos. Além disso, foi demonstrado que os macrolídeos podem exercer ações antivirais,115 apresentam a capacidade de restaurar a sensibilidade do corticoide ao inibir a via PI3K, restauram a ação da histona desacetilase 2 (HDAC2)116 e possibilitam a atenuação do TNF-a através de respostas imunes pela IL-17.117 É importante ressaltar que o tratamento complementar com azitromicina em pacientes com asma mal controlada mostrou-se uma estratégia de tratamento custo-efetiva.118
Estudo de Theron et al.119 com antagonistas do receptor de leucotrienos em concentrações dentro da faixa terapêutica e acima causaram inibição significativa relacionada à dose da geração de superóxido, bem como produção de LTB4 e liberação de elastase por neutrófilos ativados in vitro.
A teofilina é outra droga que demonstrou promover apoptose em neutrófilos e eosinófilos in vitro através da redução da proteína antiapoptótica Bcl-2.120,121 A teofilina também inibiu os neutrófilos na geração de moléculas reativas de oxigênio122 e causou um declínio na quimiotaxia de neutrófilos.123 O roflumilaste outro inibidor PDE-IV produziu melhora na função pulmonar e redução na contagem de eosinófilos e neutrófilos além de atenuar a inflamação das vias aéreas.124
Na asma Tipo 2 baixa, a IL-1β pode promover o recrutamento e ativação de neutrófilos nas vias aéreas, contribuindo para o agravamento da inflamação e da obstrução das vias respiratórias.125 Além disso, a IL-1β pode amplificar a resposta inflamatória ao induzir a produção de outras citocinas e quimiocinas pró-inflamatórias, como IL-6 e TNF-a, que também são importantes na patogênese desse subtipo de asma. A inibição da produção de IL-1β no pulmão e a subsequente inflamação foram alcançadas com o uso de inibidores farmacológicos de NLRP3 (MCC950) ou caspase-1.126 Um ensaio clínico com anakinra, um antagonista do receptor de IL-1, mostrou que ele pode
reduzir efetivamente a inflamação neutrofílica das vias aéreas sem evidenciar eventos adversos sérios.127
O tezepelumabe se constituiu no primeiro biológico a mostrar eficácia em uma população mais ampla de pacientes, embora modesta, com asma Tipo 2 baixa grave.128 Corren et al. em análise agrupada post hoc dos estudos PATHWAY e NAVIGATOR demonstraram que o tezepelumabe reduz as exacerbações em adultos com asma grave não controlada, incluindo o subgrupo Tipo 2 baixa.129
Um antagonista seletivo do receptor de quimiocina CXCR2 (AZD5069) que bloqueia os efeitos da CXCL8/IL-8 e que demonstrou reduzir significativamente a contagem absoluta de neutrófilos em pacientes com bronquiectasias foi avaliado através de um estudo multicêntrico randomizado, duplo-cego, placebo controlado em pacientes com asma grave persistente, malcontrolada. Participaram 640 pacientes com ≥ 18 anos e apesar de ser uma droga bem tolerada, não se conseguiu reduzir a frequência de exacerbações graves, nem os sintomas de asma, nem melhorar a função pulmonar, apesar de reduzir as contagens médias de neutrófilos no sangue.130
O tiotrópio demonstrou eficácia clínica em pacientes com obstrução fixa das vias aéreas, geralmente associada à inflamação neutrofílica das vias aéreas.131 Está indicado na asma como tratamento complementar nas Etapas 4 e 5 da GINA e independe de marcadores sistêmicos de inflamação.132 Os anticolinérgicos também podem reduzir a resposta inflamatória induzida pela acetilcolina, bloqueando a migração de neutrófilos.133
A Termoplastia Brônquica (TB) é um procedimento direcionado para pacientes com asma grave, onde ocorre o remodelamento das vias aéreas e as anormalidades da musculatura lisa. É uma proposta de tratamento preconizada na Etapa 5 dos Guidelines GINA,134,135 para a doença de difícil tratamento, quando são utilizadas doses média ou alta de corticoides inalatórios (CI) associadas a um segundo medicamento controle – o corticoide oral (CO), como manutenção, além de broncodilatadores ß2-agonistas de longa ação (LABA). A TB pode ser uma opção adequada ao fenótipo de doença T2-baixa.
A termoplastia brônquica melhora os sintomas e reduz exacerbações em pacientes com asma grave não controlada e fenótipo de obstrução crônica ao fluxo de ar.136,137
Referências
01.Douwes J, Gibson P, Pekkanen J Pearce N. Non-eosinophilic asthma: importance and possible mechanisms. Thorax 2002; 57:643-48.
02.Brightling CE, Symon FA, Birring SS, Bradding P, Wardlaw AJ, Pavord ID.
Comparison of airway immunopathology of eosinophilic bronchitis and asthma. Thorax 2003; 58:528-32.
03.Humbles AA, Lloyd CM, McMillan SJ. A critical role for eosinophils in allergic airways remodeling. Science 2004; 305:1776-9.
04.Norzila MZ, Fakes K, Henry RL, Simpson J, Gibson PG: lnterleukin-8 secretion and neutrophil recruitment accompanies induced sputum eosinophil activation in children with acute asthma. Am J Respir Crit Care Med 2000; 161:769-774.
05.John V, Fahya B, Kimb KW, Liub J, Homer A, Bousheya B: Prominent neutrophilic inflammation in sputum from subjects with asthma exacerbation. J Allergy Clin Immunol 1995; 95:843-852.
06.Ordonez CL, Shaughnessy TE, Matthay MA, Fahy JV. Increased neutrophil numbers and IL-8 levels in secretions in acute severe asthma: clinical and biological significance. Am J Respir Crit Care Med 2000; 161:1185-90.
07.Martin RJ, Cicutto LC, Smith HR, Ballard RD, Szefler SJ. Airways inflammation in nocturnal asthma. Am Rev Respir Dis 1991; 143:351-357.
08.Carrol N, Carello S, Cooke C, James A. Airway structure and inflammatory cells in fatal attacks of asthma. Eur Respir J 1996; 709:19:709-15.
09.Fabbri LM, Boschetto P, Zocca E, Milani G, Pivirotto F, Plebani M, Burlina A, Licata B, Mapp CE.
Bronchoalveolar neutrophilia during late asthmatic reactions induced by toluene diisocyanate. Am Rev Respir Dis 1987; 136:36–42.
10.Sastre J, Banks DE, Lopez M, Barkman HW, Salvaggio JE. Neutrophil chemotactic activity in toluene diisocyanate (TDI)-induced asthma. J Allergy Clin Immunol 1990; 85:567–572.
11.Park HS, Jung KS, Kim HY, Nahm DH, Kang KR. Neutrophil activation following TDI bronchial challenges to the airway secretion from subjects with TDI-induced asthma. Clin Exp Allergy 1999; 29:1395-1401.
12.Leigh R, Hargreave FE. Occupational neutrophilic asthma. Can Respir J 1999; 6:194-196.
13.Tarlo SM, Lemiere C. Occupational Asthma. N Engl J Med Overseas Ed 2014; 370:640-649.
14.Hekking P-PW, Bel EH. Developing and Emerging Clinical Asthma Phenotypes. J Allergy Clin Immunol 2014; 2:671–680.
15.Sur S, Crotty TB, Kephart GM, Hyma BA, Colby TV et al. Sudden onset fatal asthma: distinct entity with few eosinophils and relatively more neutrophils in the airways submocosa? Am Rev Respir Dis 1993; 148:712-19.
16.Woodruff PG, Fahy JV. A role for neutrophils in asthma? Am J Med 2002; 112:498-500.
17.Essilfie A-T, Simpson JL, Dunkley ML, et al. Combined Haemophilus influenzae respiratory infection and allergic airways disease drives chronic infection and features of neutrophilic asthma. Thorax 2012; 67:588-99.
18.Wood LG, Simpson JL, Hansbro PM, Gibson PG. Potentially pathogenic bacteria cultured from the sputum of stable asthmatics areassociated with increased 8-isoprostane and airway neutrophilia. Free Radic Res 2010; 44:146-154.
19.McGrath KW, Icitovic N, Boushey HA, Lazarus SC, Sutherland ER, Chinchilli VM, Fahy JV. A large subgroup of mild-to-moderate asthma is persistently noneosinophilic. Am J Respir Crit Care Med 2012; 185:612-619.
20.Fahy JV. Type 2 inflammation in asthma — present in most, absent in many. Nat Rev Immunol 2015; 15:57-65.
21.Crisford H, Sapey E, Rogers GB, Taylor S, Nagakumar P, Lokwani R, Simpson JL. Neutrophils in asthma: the good, the bad and the bacteria. Thorax 2021; 76:835-844.
22.European Network for Understanding Mechanisms of Severe Asthma. The ENFUMOSA cross-sectional European multicentre study of the clinical phenotype of chronic severe asthma. Eur Respir J 2003; 22:470-7.
23.Antonopoulou S, Loukides S, Papatheodorou G, et al. Airway inflammation in obstructive sleep apnea: is leptin the missing link? Respir Med 2008; 102:1399–1405.
24.Holguin F, Bleecker ER, Busse WW, Calhoun WJ, Castro M, Erzurum SC, Fitzpatrick AM, Gaston B, Israel E, Jarjour NN, Moore WC, Peters SP, Yonas M, Teague WG, Wenzel SE.
Obesity and asthma: an association modified by age of asthma onset. J Allergy Clin Immunol 2011; 127:1486–1493.e2.
25.Belda J, Leigh R, Parameswaran K, O'Byrne PM, Sears MR, Hargreave FE. Induced sputum cell counts in healthy adults. Am J Respir Crit Care Med. 2000; 161:475–478.
26.Chung KF. Neutrophilic asthma: a distinct target for treatment. Lancet Respir Med 2016; 10:765–767.
27.Nair P, Aziz–Ur–Rehman A, Radford K. Therapeutic implication of ‘neutrophilic asthma'. Curr Opin Pulm Med 2005; 21:33–38.
28.Ray A, Kolls JK. Neutrophilic inflammation in asthma is associated with disease severity. Trends Immunol 2017; 38:948–954.
29.Green RH, Brightling CE, McKenna S, et al. Asthma excerbations and sputum eosinophil: a randomised controlled trial. Lancet 2002; 360:1715-21.
30.Schleich FN, Manise M, Sele J, Henket M, Seidel L, Louis R. Distribution of sputum cellular phenotype in a large asthma cohort: predicting factors for eosinophilic vs neutrophilic inflammation. BMC Pulm Med 2013 26;13:11.
31.Wenzel SE: Asthma: defining of the persistent adult phenotypes. Lancet 2006; 368:804-813.
32. Simpson JL, Scott R, Boyle MJ, Gibson PG: Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology 2006; 11:54-61.
33.Busse WW, Holgate ST, Wenzel SW, et al. Biomarker profiles in asthma with high vs low airway reversibility and poor disease control. Chest 2015; 148:1489-96.
34.Simpson JL, Scott R, Boyle MJ, Gibson PG. Inflammatory subtypes in asthma: assessment and identification using induced sputum. Respirology 2006; 11:54-61.
35.Borregaard N. Neutrophils, from marrow to microbes. Immunity 2010; 33:657-670.
36.Rademecker C, Louis R, Bureau F, Marichal T. Role of neutrophils in allergic asthma. Curr Opin Immunol 2018; 54:28-34.
37.Parhan, P. ? O Sistema Imune. 1ª edição. Porto Alegre: Artmed; 2001.
38.Summers C, Rankin SM, Condliffe AM, Singh N, Peters AM, Chilvers ER: Neutrophil kinetics in health and disease. Trends Immunol 2010; 31:318-324.
39.Borregaard N: Neutrophils, from marrow to microbes. Immunity 2010; 33:657-670.
40.Lieschke GJ, Grail D, Hodgson G, Metcalf D, Staley E, et al. Mice lacking granulocyte colony-stimulating factor have chronic neutropenia, granulocyte and macrophage progenitor cell deficiency, and impaired neutrophil mobilization. Blood 1994; 84:1737-1746.
41.Amulic B, Cazalet C, Hayes GL, et al. Neutrophil function: from mechanisms to disease. Annu Rev Immunol 2012; 30: 459-89.
42.Crisford H, Sapey E, Stockley RA. Proteinase 3; a potential target in chronic obstructive pulmonary disease and other chronic inflammatory diseases. Respir Res 2018; 19:180.
43.Barreiro O, Zamai M, Yáñez-Mó M, Tejera E, et al. Endothelial adhesion receptors are recruited to adherent leukocytes by inclusion in preformed tetraspanin nanoplatforms J. Cell Biol 2008; 183:527-542.
44.Korkmaz B, Moreau T, Gauthier F. Neutrophil elastase, proteinase 3 and cathepsin G: physicochemical properties, activity and physiopathological functions. Biochimie 2008; 90:227-42.
45.Yipp BG, Petri B, Salina D, Jenne CN, Scott BN, Zbytnuik LD, Pittman K, Asaduzzaman M, Wu K, Meijndert HC, Malawista SE, de Boisfleury Chevance A, Zhang K, Conly J, Kubes P. Infection-induced NETosis is a dynamic process involving neutrophil multitasking in vivo. Nat Med 2012; 18:1386-93.
46.Brinkmann V, Zychlinsky A. Neutrophil extracellular traps: is immunity the second function of chromatin? J Cell Biol 2012; 198:773-83.
47.Caudrillier A, Kessenbrock K, Gilliss BM, Nguyen JX, Marques MB, Monestier M, Toy P, Werb Z, Looney MR. Platelets induce neutrophil extracellular traps in transfusion-related acute lung injury. J Clin Invest 2012; 122:2661-71.
48.Thomas GM, Carbo C, Curtis BR, Martinod K, Mazo IB, Schatzberg D, Cifuni SM, Fuchs TA, von Andrian UH, Hartwig JH, Aster RH, Wagner DD. Extracellular DNA traps are associated with the pathogenesis of TRALI in humans and mice. Blood 2012; 119:6335-43.
49.Delgado-Rizo V, Martínez-Guzmán MA, Iñiguez-Gutierrez L, García-Orozco A, Alvarado-Navarro A, Fafutis-Morris M. Neutrophil Extracellular Traps and Its Implications in Inflammation: An Overview. Front Immunol 2017; 8:81.
50.Papayannopoulos V. Neutrophil extracellular traps in immunity and disease. Nat Rev Immunol 2018; 18:134-147.
51.Krishnamoorthy N, Douda DN, Brüggemann TR, Ricklefs I, Duvall MG, Abdulnour RE, Martinod K, Tavares L, Wang X, Cernadas M, Israel E, Mauger DT, Bleecker ER, Castro M, Erzurum SC, Gaston BM, Jarjour NN, Wenzel S, Dunican E, Fahy JV, Irimia D, Wagner DD, Levy BD; National Heart, Lung, and Blood Institute Severe Asthma Research Program-3 Investigators. Neutrophil cytoplasts induce Th17 differentiation and skew inflammation toward neutrophilia in severe asthma. Sci Immunol 2018; 3(26):eaao4747.
52.Wright TK, Gibson PG, Simpson JL, McDonald VM, Wood LG, Baines KJ. Neutrophil extracellular traps are associated with inflammation in chronic airway disease. Respirology 2016; 21:467-75.
53.Lachowicz-Scroggins ME, Dunican EM, Charbit AR, Raymond W, Looney MR, Peters MC, Gordon ED, Woodruff PG, Lefrançais E, Phillips BR, Mauger DT, Comhair SA, Erzurum SC, Johansson MW, Jarjour NN, Coverstone AM, Castro M, Hastie AT, Bleecker ER, Fajt ML, Wenzel SE, Israel E, Levy BD, Fahy JV. Extracellular DNA, Neutrophil Extracellular Traps, and Inflammasome Activation in Severe Asthma. Am J Respir Crit Care Med 2019; 199:1076-1085.
54.Toussaint M, Jackson DJ, Swieboda D, Guedán A, Tsourouktsoglou TD, Ching YM, Radermecker C, Makrinioti H, Aniscenko J, Bartlett NW, Edwards MR, Solari R, Farnir F, Papayannopoulos V, Bureau F, Marichal T, Johnston SL. Host DNA released by NETosis promotes rhinovirus-induced type-2 allergic asthma exacerbation. Nat Med 2017; 23:681-691. doi: 10.1038/nm.4332. Epub 2017 May 1. Erratum in: Nat Med 2017; 23(11):1384.
55.Radermecker C, Sabatel C, Vanwinge C, Ruscitti C, Maréchal P, Perin F, Schyns J, Rocks N, Toussaint M, Cataldo D, Johnston SL, Bureau F, Marichal T. Locally instructed CXCR4hi neutrophils trigger environment-driven allergic asthma through the release of neutrophil extracellular traps. Nat Immunol. 2019; 20:1444-1455.
56. Baines KJ, Simpson JL, Wood LG, et al. Systemic upregulation of neutrophil a-defensins and serine proteases in neutrophilic asthma. Thorax 2011; 66:942-7.
57.Wright TK, Gibson PG, Simpson JL, et al. Neutrophil extracellular traps are associated with inflammation in chronic airway disease. Respirology 2016; 21:467-75.
58.Mosca T, Menezes MCS, Silva AV, et al. Chemotactic and phagocytic activity of blood neutrophils in allergic asthma. Immunol Invest 2015; 44:509-20.
59.Simpson JL, Carroll M, Yang IA, et al. Reduced antiviral interferon production in poorly controlled asthma is associated with neutrophilic inflammation and high-dose inhaled corticosteroids. Chest 2016; 149:704-13.
60.Gao P, Gibson PG, Baines KJ, et al. Anti-Inflammatory deficiencies in neutrophilic asthma: reduced galectin-3 and IL-1RA/IL-1ß. Respir Res 2015; 16:5.
61.Simpson JL, Grissell TV, Douwes J, et al. Innate immune activation in neutrophilic asthma and bronchiectasis. Thorax 2007; 62:211-8.
62.Simpson JL, Phipps S, Baines KJ, et al. Elevated expression of the NLRP3 inflammasome in neutrophilic asthma. Eur Respir J 2014; 43: 1067-76
63.Niessen NM, Baines KJ, Simpson JL, Scott HA, Qin L, Gibson PG, Fricker M. Neutrophilic asthma features increased airway classical monocytes. Clin Exp Allergy 2021; 51:305-317.
64.Green RH, Brightling CE, Woltmann G, Parker D, Wardlaw AJ, Pavord ID. Analysis of induced sputum in adults with asthma: identification of subgroup with isolated sputum neutrophilia and poor response to inhaled corticosteroids. Thorax 2002;57:875-9.
65.Wenzel SE, Szefler SJ, Leung DY, Sloan SI, Rex MD, Martin RJ. Bronchoscopic evaluation of severe asthma: persistent inflammation associated with high dose glucocorticoids. Am J Respir Crit Care Med 1997; 156:737-43.
66.Fahy JV, Kim KW, Liu J, Boushey HA. Prominent neutrophilic inflammation in sputum from subjects with asthma exacerbation. J Allergy Clin Immunol 1995;95: 843-52.
67.Norzila MZ, Fakes K, Henry RL, Simpson J, Gibson PG. Interleukin-8 secretion and neutrophil recruitment accompanies induced sputum eosinophil activation in children with acute asthma. Am J Respir Crit Care Med 2000;161:769-74.
68.Simpson JL, Grissell TV, Douwes J, Scott RJ, Boyle MJ, Gibson PG. Innate immune activation in neutrophilic asthma and bronchiectasis. Thorax 2007; 62(3):211-218.
69.Chang HS, Lee T‐H, Jun JA, et al. Neutrophilic inflammation in asthma: mechanisms and therapeutic considerations. Expert Rev Respir Med 2017;11(1):29-40.
70.Fu JJ, McDonald VM, Baines KJ, Gibson PG. Airway IL‐1beta and systemic inflammation as predictors of future exacerbation risk in asthma and COPD. Chest 2015; 148(3):618-629.
71.Robinson PFM, Pattaroni C, Cook J, et al. Lower airway microbiota associates with inflammatory phenotype in severe preschool wheeze. J Allergy Clin Immunol 2019; 143:1607–10.
72.Grunwell JR, Stephenson ST, Tirouvanziam R, et al. Children with NeutrophilPredominant severe asthma have proinflammatory neutrophils with enhanced survival and impaired clearance. J Allergy Clin Immunol Pract 2019; 7:516–25.
73.Sun Y-chang, Zhou Q-tao, Yao W-zhen. Sputum interleukin-17 is increased and associated with airway neutrophilia in patients with severe asthma. Chin Med J 2005; 118:953-6.
74.Moore WC, Hastie AT, Li X, et al. Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis. J Allergy Clin Immunol 2014; 133:1557-63.
75.Sur S, Crotty TB, Kephart GM, et al. Sudden-onset fatal asthma. A distinct entity with few eosinophils and relatively more neutrophils in the airway submucosa? Am Rev Respir Dis 1993; 148:713-9.
76.Cardet JC, Ash S, Kusa T, et al. Insulin resistance modifies the association between obesity and current asthma in adults. Eur Respir J 2016; 48:403-10.
77.Park YH, Oh EY, Han H, et al. Insulin resistance mediates high-fat diet-induced pulmonary fibrosis and airway hyperresponsiveness through the TGF-ß1 pathway. Exp Mol Med 2019; 51:1-12.
78.Panettieri RA Jr. The role of neutrophils in asthma. Immunol Allergy Clinics North Am 2018; 38(4):629-638.
79.Wenzel SE, Szefler SJ, Leung DY, Sloan SI, Rex MD, Martin RJ: Bronchoscopic evaluation of severe asthma. Persistent inflammation associated with high dose glucocorticoids. Am J Respir Crit Care Med 1997; 156:737-743.
80.Vachier I, Kumlin M, Dahlen SE, Bousquet J, Godard P, Chanez P: High levels of urinary leukotriene E4 excretion in steroid treated patients with severe asthma. Respir Med 2003; 97:1225-1229.
81.Jatakanon A, Uasuf C, Maziak W, Lim S, Chung KF, Barnes PJ: Neutrophilic inflammation in severe persistent asthma. Am J Respir Crit Care Med 1999; 160: 1532-1539.
82.Montuschi P, Barnes PJ. Exhaled leukotrienes and prostaglandins in asthma. J Allergy Clin Immunol 2002; 109:615-20.
83.Vachier I, Bonnans C, Chavis C, Farce M, Godard P, Bousquet J, Chanez P: Severe asthma is associated with a loss of LX4, an endogenous anti-inflammatory compound. J Allergy Clin Immunol 2005; 115:55-60.
84.Detmers PA, Lo SK, Olsen-Egbert E, Walz A, Baggiolini M, Cohn ZA. Neutrophil activating protein 1/interleukin 8 stimulates the binding activity of the leukocyte adhesion receptor CD11b/CD18 on human neutrophils. J Exp Med 1990; 171:1155-62.
85.Detmers PA, Powell DE, Walz A, Clark-Lewis I, Baggiolini M, Cohn ZA. Differential effects of neutrophil-activating peptide 1/IL-8 and its homologues on leukocyte adhesion and phagocytosis. J Immunol 1991; 147:4211-7.
86.Bussolino F, Sironi M, Bocchietto E, Mantovani A. Synthesis of platelet-activating factor by polymorphonuclear neutrophils stimulated with interleukin-8. J Biol Chem 1992; 267:14598-603.
87.Alcorn JF, Crowe CR, Kolls JK. Th17 cells in asthma and COPD. Annu Rev Physiol 2010; 72:495-516.
88.Sun YC, Zhou QT, Yao WZ. Sputum interleukin-17 is increased and associated with airway neutrophilia in patients with severe asthma. Chin Med J (Engl) 2005; 118:953-6.
99.Shimoda T, Obase Y, Kishikawa R, et al. Influence of cigarette smoking on airway inflammation and inhaled corticosteroid treatment in patients with asthma. Allergy Asthma Proc 2016; 37:50-8.
90.Thomson NC, Chaudhuri R, Livingston E. Asthma and cigarette smoking. Eur Respir J 2004; 24:822-33.
91.Siew LQC, Wu S-Y, Ying S, Corrigan CJ. Cigarette smoking increases bronchial mucosal IL-17A expression in asthmatics, which acts in concert with environmental aeroallergens to engender neutrophilic inflammation. Clinical & Experimental Allergy 2017; 47:740-750.
92.Nakajima H, Hirose K. Role of IL-23 and Th17 Cells in Airway Inflammation in Asthma. Immune Netw 2010; 10:1-4.
93.McGeachy MJ, Chen Y, Tato CM, Laurence A, Joyce-Shaikh B, Blumenschein WM, McClanahan TK, O'Shea JJ, Cua DJ. The interleukin 23 receptor is essential for the terminal differentiation of interleukin 17-producing effector T helper cells in vivo. Nat Immunol 2009; 10:314-24.
94.Langrish CL, Chen Y, Blumenschein WM, Mattson J, Basham B, Sedgwick JD, McClanahan T, Kastelein RA, Cua DJ. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation. J Exp Med 2005; 201:233-40.
95.Hizawa N, Kawaguchi M, Huang SK, Nishimura M. Role of interleukin-17F in chronic inflammatory and allergic lung disease. Clin Exp Allergy 2006; 36:1109-14.
96.Iwakura Y, Ishigame H. The IL-23/IL-17 axis in inflammation. J Clin Invest 2006; 116:1218-22.
97.Han S, Kim B, Hyeon DY, Jeong D, Ryu J, Nam JS, Choi YH, Kim BR, Park SC, Chung YW, Shin SJ, Lee JY, Kim JK, Park J, Lee SW, Kim TB, Cheon JH, Cho HJ, Kim CH, Yoon JH, Hwang D, Ryu JH. Distinctive CD39+CD9+ lung interstitial macrophages suppress IL-23/Th17-mediated neutrophilic asthma by inhibiting NETosis. Nat Commun 2024; 15:8628.
98.Busse WW, Holgate S, Kerwin E, Chon Y, Feng J, Lin J, Lin SL. Randomized, double-blind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma. Am J Respir Crit Care Med 2013; 188:1294-302.
99.Brightling CE, Nair P, Cousins DJ, Louis R, Singh D. Risankizumab in Severe Asthma - A Phase 2a, Placebo-Controlled Trial. N Engl J Med 2021; 385:1669-1679.
100.Barnes PJ. New molecular targets for the treatment of neutrophilic diseases. J Allergy Clin Immunol 2007; 119:1055-62.
101.Meagher LC, Cousin JM, Seckl JR, Haslett C. Opposing effects of glucocorticoids on the rate of apoptosis in neutrophilic and eosinophilic granulocytes. J Immunol 1996; 156:4422-8.
102.Nguyen LT, Lim S, Chung KF. Increase in airway neutrophils after oral but not inhaled inhaled corticosteroid therapy in mild asthma. Respir Med 2005; 99:200-7.
103.Zhang Q, Illing R, Hui CK, et al. Bacteria in sputum of stable severe asthma and increased airway wall thickness. Respir Res 2012; 13:35.
104.Wood LG, Simpson JL, Hansbro PM, Gibson PG. Potentially pathogenic bacteria cultured from the sputum of stable asthmatics are associated with increased 8-isoprostane and airway neutrophilia. Free Radic Res 2010; 44:146–54.
105.Fitzpatrick AM, Holguin F, Teague WG, Brown LA. Alveolar macrophage phagocytosis is impaired in children with poorly controlled asthma. J Allergy Clin Immunol 2008; 121:1372–78.
106.Huynh ML, Malcolm KC, Kotaru C, et al. Defective apoptotic cell phagocytosis attenuates PGE2 and 15-HETE in severe asthma alveolar macrophages. Am J Respir Crit Care Med 2005; 172:972–79.
107.Nguyen LT, Lim S, Oates T, Chung KF. Oral but not inhaled corticosteroid therapy increases airway neutrophils in asthma. Respir Med 2005; 99:200–07.
108.Al-Ramli W, Prefontaine D, Chouiali F, et al. T(H)17-associated cytokines (IL-17A and IL-17F) in severe asthma. J Allergy Clin Immunol 2009; 123:1185–87.
109.Chung KF. New treatments for severe treatments-resistant asthma: targeting right patient. Lancer Respír Med 2013:1639-52.
110.Maneechotesuwan K, Essilfie-Quaye S, Meah S, Kelly C, Kharitonov SA, Adcock IA, Barnes PJ. Formoterol attenuates neutrophilic airway inflammation in asthma. Chest 2005; 128:1936-42.
11.Bowden JJ, Sulakvelidze I, McDonald DM. Inhibition of neutrophil and eosinophil adhesion to venules of rat trachea by B2-adrenergic agonist formoterol. J Appl Physiol 1994; 77:397-40.
112.Jeffery PK, Venge P, Gizycki MJ, et al. Effects of salmeterol on mucosal inflammation in asthma: a placebo-controlled study. Eur Respir J 2002; 20:1378-85.
113.Simpson JL, Powell H, Boyle MJ, Scott RJ, Gibson PG. Clarithromycin targets neutrophilic airway inflammation in refractory asthma. Am J Respir Crit Care Med 2008; 177:148-55.
114.Gibson PG, Yang IA, Upham JW, Reynolds PN, Hodge S, James AL, Jenkins C, Peters MJ, Marks GB, Baraket M, Powell H, Simpsom JL.
. Efficacy of azithromycin in severe asthma from the AMAZES randomised trial. ERJ Open Res 2019 Oct; 5(4). DOI: 10.1183/23120541.00056-2019.
115.Schögler A, Kopf BS, Edwards MR, et al. Novel antiviral properties of azithromycin in cystic fibrosis airway epithelial cells. Eur Respir J 2015; 45:428-439.
116.Essilfie AT, Horvat JC, Kim RY, et al. Macrolide therapy suppresses key features of experimental steroid-sensitive and steroid-insensitive asthma. Thorax 2015; 70:458-467.
117.Kobayashi Y, Wada H, Rossios C, et al. A novel macrolide solithromycin exerts superior anti-inflammatory effect via NF-?B inhibition. J Pharmacol Exp Ther 2013; 345:76-84.
118.O'Neill C, Gibson PG, Heaney LG, Upham JW, Yang IA, Reynolds PN, Hodge S, Jenkins CR, Peters M, Marks GB, James AL, Simpson JL. The cost-effectiveness of azithromycin in reducing exacerbations in uncontrolled asthma. Eur Respir J 2021; 57:2002436.
119.Theron AJ, Steel HC, Tintinger GR, Gravett CM, Anderson R, Feldman C. Cysteinyl leukotriene receptor-1 antagonists as modulators of innate immune cell function. J Immunol Res 2014; 2014:608930.
doi: 10.1155/2014/608930. Epub 2014 May 25. PMID: 24971371; PMCID: PMC4058211.
120.Yasui K, Hu B, Nakazawa T, Agematsu K, Komiyama A. Theophylline accelerates human granulocyte apoptosis not via phosphodiesterase inhibition. J Clin Investig 1997; 100(7):1677-1684.
121. Chung IY, Nam‐Kung EK, Lee NM, et al. The downregulation of Bcl-2 expression is necessary for theophylline-induced apoptosis of eosinophil. Cell Immunol 2000; 203(2):95-102.
122.Nielson CP, Crowley JJ, Morgan ME, Vestal RE. Polymorphonuclear leukocyte inhibition by therapeutic concentrations of theophylline is mediated by cyclic-3′,5′-adenosine monophosphate. Am Rev Respir Dis 1988; 137(1):25-30.
123.Yasui K, Agematsu K, Shinozaki K, et al. Effects of theophylline on human eosinophil functions: comparative study with neutrophil functions. J Leukoc Biol 2000; 68(2):194-200.
124.Bardin P, Kanniess F, Gauvreau G, et al. Roflumilast for asthma: efficacy findings in mechanism of action studies. Pulm Pharmacol Ther 2015; 35 Suppl:S4-10.
125.Schworer SA, Chason KD, Chen G, Chen J, Zhou H, Burbank AJ, Kesic MJ, Hernandez ML. IL-1 receptor antagonist attenuates proinflammatory responses to rhinovirus in airway epithelium. J Allergy Clin Immunol 2023; 151:1577-1584.e4.
126.Kim RY, Pinkerton JW, Essilfie AT, Robertson AAB, Baines KJ, Brown AC, Mayall JR, Ali MK, Starkey MR, Hansbro NG, Hirota JA, Wood LG, Simpson JL, Knight DA, Wark PA, Gibson PG, O'Neill LAJ, Cooper MA, Horvat JC, Hansbro PM. Role for NLRP3 Inflammasome-mediated, IL-1ß-Dependent Responses in Severe, Steroid-Resistant Asthma. Am J Respir Crit Care Med 2017; 196:283-297.
127.Hernandez ML, Mills K, Almond M, Todoric K, Aleman MM, Zhang H, Zhou H, Peden DB. IL-1 receptor antagonist reduces endotoxin-induced airway inflammation in healthy volunteers. J Allergy Clin Immunol 2015; 135:379-85.
128.Brusselle GG, Koppelman GH. Biologic therapies for severe asthma. N Engl J Med 2022; 386:157-171.
129.Corren J, Menzies-Gow A, Chupp G, Israel E, Korn S, Cook B, et al. Efficacy of tezepelumab in severe, uncontrolled asthma: pooled analysis of the PATHWAY and NAVIGATOR studies. Am J Respir Crit Care Med 2023; 208:13-24.
130.O’Byrne PM, Metev H, Puu M, et al. Efficacy and safety of a CXCR2 antagonist, AZD5069, in patients with uncontrolled persistent asthma: a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2016; 4:797-806.
131.Radovanovic D, Santus P, Blasi F, Mantero M. The evidence on tiotropium bromide in asthma: from the rationale to the bedside. Multidiscip Respir Med 2017; 12:12.
doi: 10.1186/s40248-017-0094-3. Erratum in: Multidiscip Respir Med. 2017; 12 :17. PMID: 28484598; PMCID: PMC5420159.
132.Szefler SJ, Vogelberg C, Bernstein JA, Goldstein S, Mansfield L, Zaremba-Pechmann L, Engel M, Hamelmann E. Tiotropium Is Efficacious in 6- to 17-Year-Olds with Asthma, Independent of T2 Phenotype. J Allergy Clin Immunol Pract 2019; 7:2286-2295.e4.
133.Bühling F, Lieder N, Kühlmann UC, Waldburg N, Welte T. Tiotropium suppresses acetylcholine-induced release of chemotactic mediators in vitro. Respir Med 2007; 101:2386-94.
134.Global Initiative for Asthma. Global Strategy for Asthma Management and Prevention uptdated 2021. Disponível em: https://ginasthma.org/wp-content/uploads/2021/05/GINA-Main-Report-2021-V2-WMS.pdf . Acesso em: 28 de maio de 2021.
135.Global Initiative for Asthma. Difficult-To-Treat & Severe Asthma in adolescent and adult patients. Diagnosis and Management. Disponível em : https://ginasthma.org/wp-content/uploads/2019/04/GINA-Severe-asthma-Pocket-Guide-v2.0-wms-1.pdf . Acesso em: 10 de outubro de 2019.
136.Laxmanan B, Hogarth DK. Bronchial thermoplasty in asthma: current perspectives. J Asthma Allergy 2015; 8:39-49.
137.Chupp G, Laviolette M, Cohn L, McEvoy C, Bansal S, Shifren A, Khatri S, Grubb GM, McMullen E, Strauven R, Kline JN; Other members of the PAS2 Study Group. Long-term outcomes of bronchial thermoplasty in subjects with severe asthma: a comparison of 3-year follow-up results from two prospective multicentre studies. Eur Respir J 2017 Aug 31;50(2):1700017. Erratum in: Eur Respir J 2017; 50.
|
|
Home
 Design by Walter Serralheiro Design by Walter Serralheiro
|
|
|