|
Asma
INFLAMAÇÃO ALÉRGICA
Para a melhor compreensão sobre os mecanismos da inflamação da asma, focaremos no endótipo da forma mais comum de asma, a asma alérgica, cujos sintomas são frequentemente desencadeados por alérgenos. Em pacientes com asma alérgica, a provocação com alérgenos pode causar ativação de mastócitos de forma antígeno-específica, dependente de IgE, levando à liberação de mediadores de mastócitos.
Estudos evidenciam que após a inalação de alérgenos em indivíduos suscetíveis, falhas no epitélio favorecem a penetração, ativação e liberação de citocinas derivadas pelo epitélio respiratório, através da ativação de receptores toll-like (TLRs) ou receptores ativados por protease (PARs).1 Estas recrutam e ativam as células apresentadoras de antígenos (APCs), em particular as células dendríticas (CDs), que capturam os alérgenos e os apresentam aos linfócitos T naïve, que se tornam Th2 polarizadas.
Células Th2 liberam citocinas pró-inflamatórias como IL-4, IL-5, IL-9 e IL-13. As citocinas derivadas do epitélio também ativam as células linfoides inatas Tipo 2 (ILC2s), que também liberam IL-5 e IL-13.
A IL-5 favorece a eosinofilia nos tecidos e na circulação.2,3-6
➢Interações entre a Célula Apresentadora de Antígenos, o Linfócito T e a Sua Ativação
Na asma alérgica as células dendríticas são as principais células apresentadoras de antígenos (APCs) e entre as APCs são as únicas a ativar as células T naïves. Derivam do precursor CD34+ da medula óssea, e correspondem a 0,2% dos leucócitos no sangue, onde transitam por curto espaço de tempo. Recebem esta denominação por apresentar longos braços, ou dendritos, sendo  encontradas em vários tecidos, particularmente na pele e nas mucosas. São encontradas no epitélio brônquico, onde são 4 a 8 vezes mais potentes do que os macrófagos alveolares como células apresentadoras de antígeno.7 Constitutivamente produzem um alto nível de proteínas MHC Classe II e a proteína coestimuladora B-7, estando presentes em grande número no epitélio e submucosa das vias aéreas superiores e inferiores. A mucosa está coberta por uma extensa rede de CD, que se encontram nos canais para e intercelulares que circundam as células do epitélio basal.
As CDs têm um papel importante não apenas na sensibilização a alérgenos, mas também na asma, sendo que o seu número se encontra bastante elevado na mucosa em pacientes com asma.8 Nos brônquios, o espaço intercelular lateral é isolado do ambiente externo por união compacta do epitélio. Para interagir com as CDs, potenciais aeroalérgenos devem atravessar o epitélio para alcançar este espaço. Em todos os tecidos não linfoides, as CDs encontram-se em estado latente, também conhecido como estado imaturo, especializado para a captação de antígenos, que pode ocorrer por três mecanismos: via endocitose receptor-mediada, envolvendo clathrin-coated, via macropinocitose e via fagocitose particulada. encontradas em vários tecidos, particularmente na pele e nas mucosas. São encontradas no epitélio brônquico, onde são 4 a 8 vezes mais potentes do que os macrófagos alveolares como células apresentadoras de antígeno.7 Constitutivamente produzem um alto nível de proteínas MHC Classe II e a proteína coestimuladora B-7, estando presentes em grande número no epitélio e submucosa das vias aéreas superiores e inferiores. A mucosa está coberta por uma extensa rede de CD, que se encontram nos canais para e intercelulares que circundam as células do epitélio basal.
As CDs têm um papel importante não apenas na sensibilização a alérgenos, mas também na asma, sendo que o seu número se encontra bastante elevado na mucosa em pacientes com asma.8 Nos brônquios, o espaço intercelular lateral é isolado do ambiente externo por união compacta do epitélio. Para interagir com as CDs, potenciais aeroalérgenos devem atravessar o epitélio para alcançar este espaço. Em todos os tecidos não linfoides, as CDs encontram-se em estado latente, também conhecido como estado imaturo, especializado para a captação de antígenos, que pode ocorrer por três mecanismos: via endocitose receptor-mediada, envolvendo clathrin-coated, via macropinocitose e via fagocitose particulada.
O sistema imunológico contém três tipos de APCs "profissionais", isto é, macrófagos, CDs e células B.
Outras APCs são também encontradas constitutivamente ou sob condições inflamatórias no trato respiratório, como os macrófagos, os linfócitos B e os pneumócitos Tipo II, os quais apresentam também funções na atividade imune e de supressão.

As CDs, em particular, participam na sensibilização alérgica primária e secundária. Durante a resposta primária, as CDs provenientes da medula óssea são atraídas por quimiocinas inflamatórias MIP-3a (macrophage inflammatory protein) até os tecidos, onde capturam os antígenos. O reconhecimento do alérgeno constitui um sinal de alerta, que induz à maturação das CDs. Migram até os linfáticos regionais, tornam-se responsivas às células de revestimento sinusoidal expressas no endotélio do linfático aferente e a MIP-3ß, expressa na área de células T dos linfonodos. Nos linfonodos as CDs se agrupam. Caracterizam-se pela expressão constitutiva das moléculas do complexo principal de histocompatibilidade MHC classe II, e moléculas coestimuladoras. Atraem e interagem com células T naïves para induzir uma resposta imune primária, gerando células Th2 efetoras e células T reguladoras que controlam a síntese de IgE pelos linfócitos B. As células Th2 efetoras, por sua vez, migrarão via linfáticos eferentes para recirculação na corrente sanguínea. No caso de se depararem repetidamente ou continuadamente com o alérgeno, estes linfócitos Th2 estão disponíveis para migrar até os locais de inflamação e provavelmente podem ser estimulados pelas CDs locais, que apresentam a IgE via receptor FcεRI, para gerar inflamação eosinofílica das vias aéreas, hiperplasia de células caliciformes e hiper-responsividade brônquica. As CDs têm a capacidade de produzir monocyte derived chemokine (MDC) e thymus and activation regulated chemokine (TARC) que são quimiotáticos para as células Th2. (Figura 1)
As moléculas MHC são glicoproteínas transmembrana codificadas por um extenso grupo de genes conhecido como complexo principal de histocompatibilidade (MHC). Sua característica estrutural mais notável é a presença de uma fenda na superfície extracelular, onde peptídios podem se ligar.
As moléculas MHC classe II são proteínas heterodímeras, compostas por duas cadeias polipeptídicas a e b, cada qual contribuindo com um domínio ao sítio de ligação ao peptídio e um domínio de suporte semelhante à imunoglobulina. São sintetizadas no retículo endoplasmático da célula, de onde se transferem para o aparelho de Golgi, ligadas a uma terceira proteína chamada de cadeia invariante (Ii) (CD74), que evita qualquer ligação prematura de peptídios endógenos ao seu sítio de ligação, até que ela atinja o local da degradação proteica extracelular. Uma segunda função da cadeia invariante é enviar moléculas MHC II para as vesículas endocíticas (de pH baixo) onde elas se ligam ao peptídio. Do aparelho de Golgi, as MHC II são transferidas para vesículas onde se acumulam. Os peptídios antigênicos, provenientes de proteínas estranhas fagocitadas, degradadas e digeridas por enzimas proteolíticas da família das catepsinas, apresentam um tamanho que varia de 13–18 aminoácidos de comprimento e acumulam-se nos fagolisossomos da célula. Posteriormente as vesículas que contêm as MHC classe II se fundem com os lisossomos, em ambiente ácido, dissociando-se das cadeias Ii, permitindo que os peptídios provenientes dos antígenos fagocitados se unam à fenda de ligação do peptídio da molécula MHC.9
Como as moléculas MHC são altamente polimórficas e a mesma célula exprime várias moléculas MHC, isso explica como uma mesma célula pode apresentar um conjunto de peptídios aos linfócitos T.
Os complexos resultantes desta fusão são carreados para a superfície destas células, onde linfócitos CD4+ T auxiliares (Th2) residentes intraepiteliais os reconhecem através de receptores específicos de sua superfície (TCR), compostos heterodímeros constituídos por um par de cadeias polipeptídicas (a/ß ou γ/d) cuja análise da sequência de aminoácidos mostra uma grande similaridade com a estrutura domínio das imunoglobulinas. A ligação do TCR ao MHC + peptídio representa um complexo trimolecular.
A ativação das células T naïves requer uma sinalização direta por duas vias:
• Através da ligação entre o TCR e o complexo MHC-II da célula apresentadora de antígeno e
• Pela via coestimuladora através da família B7 e o CD28 dos linfócitos
Uma vez que o TCR tenha reconhecido seu antígeno cognato apresentado pela molécula MHC II, o próximo passo é a transmissão de um sinal da superfície da célula, onde ocorre o reconhecimento até o núcleo da mesma, para que a célula T passe do estado “inativo” para o estado de “ativação”. Para isto, torna-se necessária a alteração na gene expressão no núcleo da célula. Normalmente este tipo de sinalização através da membrana celular envolve uma proteína transmembrana que apresenta duas partes: uma região externa (ligante), cuja função é a de ligar-se à molécula que está fora da célula e uma região interna que inicia a cascata bioquímica que conduz o sinal ao núcleo celular. O receptor de células T reconhece características tanto do antígeno peptídico quanto da molécula do MHC à qual ele está ligado. Isso introduz uma dimensão extra ao reconhecimento de antígenos pelas células T, conhecida como restrição do MHC porque qualquer receptor de células T é específico para um peptídio específico ligado a uma molécula específica do MHC.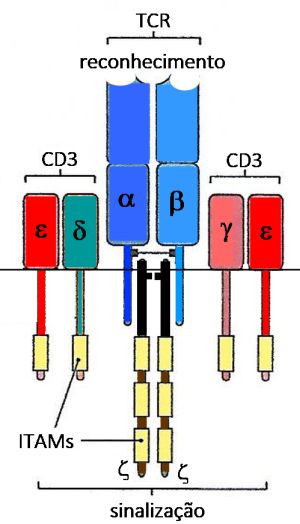
As cadeias aß do TCR apresentam um domínio extracelular TCR α:β que se une ao seu ligante (combinação da molécula MHC e o peptídio).
Os seus prolongamentos internos citoplasmáticos são muito curtos para qualquer sinalização, pois são constituídos por apenas três aminoácidos. Esta sinalização prossegue através de um complexo de proteínas coletivamente chamado de CD3. O complexo CD3 é necessário para a transdução do sinal durante o processo de reconhecimento do antígeno, resultante de sua ligação ao TCR. Em humanos este complexo de sinalização é constituído por quatro diferentes polipeptídios: γ, d, ε e z (gama, delta, epsílon e zeta). Torna-se necessário salientar, todavia, que as proteínas γ e d que fazem parte do complexo CD3 não são as mesmas proteínas γ e d que constituem o γd TCR. As proteínas CD3 estão fixadas à membrana celular e apresentam prolongamentos citoplasmáticos que são suficientemente longos, e cada cadeia de CD3 tem um ITAM
(immunoreceptor tyrosine-based activation motifs), mostrado como um segmento amarelo enquanto cada cadeia
z tem três ITAMs para iniciar o sinal de ativação e a transmissão do sinal para o núcleo. (Figura 2)
Além de terem o TCR ligado ao complexo MHC-peptídio, as células T devem também receber sinais de coestimulação antes que elas possam ser ativadas. O sinal de coestimulação melhor estudado é aquele constituído por uma família de moléculas expressa na superfície das APCs, chamada B7. As moléculas desta família, a B7-1 (CD80) e a B7-2 (CD86), produzem a coestimulação das células T pela ligação a receptores de sua superfície. Dois destes receptores foram identificados: CD28 e CTLA-4 (cytolytic T lymphocyte associated antigen-4). A maioria das células T expressa o CD28, enquanto que o CTLA-4 somente é expresso após a ativação da célula, podendo funcionar como um regulador negativo (“desativador”). Além das moléculas B7, as APCs secretam citocinas que também contribuem para a coestimulação. O que tem sido descrito é que diferentes APCs em diferentes lugares expressam diferentes combinações de moléculas coestimuladoras e citocinas. Por exemplo, os macrófagos expressam B7-1 e a citocina IL-1; as CDs expressam iguais quantidades de B7-1 e B7-2; as células B ativadas expressam mais B7-1 do que B7-2. A conclusão mais plausível é de que diferentes APCs produzem diferentes tipos de sinais de coestimulação para as células T e estes diferentes sinais podem influenciar os tipos de citocinas que as células TH produzem.
Quando as APCs veem um antígeno e o cortam em peptídios para apresentação em um complexo com moléculas de MHC para ativar as células T, eles também aumentam a regulação dos ligantes para algumas dessas moléculas coestimulatórias, tornando-os capazes de ativar as células T específicas. Por exemplo, os ligantes de CD28 (B7-1 e B7-2, também chamados CD80 e CD86) são induzidos em APCs e permitem a ativação de CD28 nas células T.
Além da apresentação de antígenos peptídicos específicos por moléculas MHC, outros sinais são necessários para a ativação dos linfócitos T (CD25) como a IL-1 secretada pelas CDs e a própria interação física entre as duas células. Uma vez ativados, os linfócitos T apresentam em sua superfície receptores para sua autoproliferação. Isto ocorre após as células T serem ativadas, pois necessitam proliferar (clonagem seletiva) e esta proliferação é acionada pelas citocinas como a IL-2 que atua como um fator de crescimento. As células T estimuladas via TCR, em ausência de sinais de coestimulação, são incapazes de secretar a IL-2 e de ativar-se e por esta razão entram em um estado anérgico. As células T ativadas passam então a secretar citocinas necessárias para ativar os linfócitos B.
➢Interações entre o Linfócito T Ativado e o Linfócito B, Proliferação e Síntese de Anticorpos IgE
Parte dos linfóciotos Th2 dos linfonodos que drenam os pulmões interagirá com linfócitos B que se diferenciarão em plasmócitos e células produtoras de anticorpos para secretarem a imunoglobulina E (IgE) através do que se convencionou chamar de modelo de dois sinais.
O primeiro é fornecido pelas IL-4 e IL-13 sintetizadas pelos linfócitos Th2.10,11 Os mastócitos, os basófilos e os eosinófilos também produzem IL-4, enquanto que a IL-13 também é sintetizada pelas células NK. As IL-4 e IL-13 compartilham a cadeia α do receptor IL-4 (IL-4Ra), quando estas citocinas se ligam aos receptores nas células B.12,13 As citocinas e quimiocinas produzidas pelas células Th2 amplificam a resposta Th2 e estimulam a mudança de classe das células B ativadas para a produção de IgE. A IL-4 ou a IL-13 fornecem o primeiro sinal que muda as células B para a produção de IgE. A IL-4 e a IL-13 que atuam nos linfócitos T e B ativam as tirosina-quinases Jak1 e Jak3 da família Janus, conduzindo, em última análise, à fosforilação (e, por conseguinte, à ativação) do regulador da transcrição regulador de transcrição STAT-6 (signal transduction-activated transcription-6). Uma vez acopladas, resulta a translocação para o núcleo do STAT-6, o qual estimula a transcrição do lócus do gene Cε, contendo sequências codificadoras (éxons) para as regiões constantes da cadeia pesada e da IgE. O segundo sinal ocorre, por contato, através da interação entre a proteína transmembrana chamada Ligante CD40 (CD40L ou CD154) expressa na superfície dos linfócitos T auxiliares ativados, com o receptor CD40, uma molécula coestimuladora dos linfócitos B.14-16 Esta ação mútua entre as duas moléculas desencadeia uma reorganização genética (deletion switch recombination) que aproxima todos os elementos da cadeia funcional pesada ε. O resultado é uma completa codificação genética multiéxon da cadeia pesada ε. A combinação destes dois sinais determina um desvio de classe para a IgE e proliferação das células B.

Interações adicionais entre outros pares de ligantes e receptores (entre B7-2/CD28 e B-7-2/CTLA-4 e entre a integrina αLß2 e a molécula de adesão intercelular-1 – ICAM-1) podem complementar ou upregulate a ativação dependente de célula T dos linfócitos B, que se segue à ligação do CD40 ao seu ligante.
Os linfócitos B diferenciam-se em células secretoras de anticorpos (plasmócitos), cujo resultado é a expressão dos RNA mensageiros (curto e longo) da IgE e consequente síntese proteica da IgE específica para alérgenos específicos (Figura 3).
Embora a produção de IgE ocorra principalmente em órgãos linfoides secundários, há evidências de que esse evento também possa acontecer na mucosa pulmonar de pacientes com asma (a chamada produção local de IgE).17 Uma vez sintetizados e ativados (um só linfócito B é capaz de produzir mais de 10 milhões de anticorpos por hora), os anticorpos IgE circulam por curto período de tempo no sangue antes de se ligarem aos receptores de alta afinidade (FcεRI) na superfície dos mastócitos teciduais, nos basófilos, eosinófilos, do sangue periférico,
em células musculares lisas das vias aéreas, células endoteliais e epiteliais18 e a receptores IgE de baixa afinidade (FcεRII, ou CD23) na superfície de linfócitos, eosinófilos, plaquetas e macrófagos.
➢Imunoglobulina E – IgE

Desde o final da década de 1960 a relação entre a síntese de anticorpos da classe IgE e a resposta imediata de hipersensibilidade contra alérgenos ambientais (sensibilização) está bem estabelecida. A IgE (o "E" foi escolhido devido ao eritema e pápula da reação cutânea alérgica) apresenta um peso molecular de 188 kDa. A sua concentração sérica normal no adulto é de aproximadamente 100 UI/mL ou (100 kU/L) e corresponde a 0,002% do total das imunoglobulinas. A meia-vida da IgE livre é de cerca de 2–3 dias, porém uma vez ligada aos seus receptores nos mastócitos e basófilos, mantém-se estável por semanas. A IgE é constituída por duas cadeias leves (L) idênticas e duas cadeias pesadas (H) idênticas, sendo cada cadeia constituída por 110 aminoácidos, unidas por ligações covalentes, através de pontes dissulfeto. Cada cadeia apresenta uma região variável (V) e outra constante (C). O sítio de reconhecimento do antígeno ocorre na região variável, enquanto que na extremidade oposta acontece o acoplamento à célula, via receptores específicos de imunoglobulinas. A IgE caracteriza-se por apresentar uma longa região constante, com quatro domínios Cε1, Cε2, Cε3 e Cε4, ao contrário das outras imunoglobulinas que só possuem três.
Este fato proporciona uma excepcional habilidade de acoplamento a receptores especializados de alta afinidade FcεRI. O exato local de união ocorre na sequência N-terminal do terceiro domínio (Cε3) da cadeia pesada, perto da junção com Cε2.19,20 (Figura 4)
Uma reação dita precoce ou imediata se manifesta por aumento da resistência das vias aéreas, 10 a 15 minutos após contato com o alérgeno nos pacientes sensibilizados. Neste estágio a obstrução brônquica é reversível espontaneamente ou através de inalação de um broncodilatador.
➢Mastócitos
Imediatamente após a inalação do alérgeno, os mastócitos tipo MCT (fenótipo que contém triptase) no pulmão e os mastócitos tipo MCTC (fenótipo que contém proteases neutras triptase e quimase) predominante na mucosa nasal,21 sensibilizados previamente pela IgE, são ativados pelo acoplamento do antígeno (ligação cruzada) aos receptores IgE da superfície de sua membrana celular. Deve ser salientado que ambos os tipos de mastócitos expressam o receptor de alta afinidade FcεRI e podem, portanto, participar das reações alérgicas dependentes da IgE. Funcionalmente, entretanto, os dois tipos de célula apresentam diferenças: o MCT está relacionado ao sistema imune, enquanto que o MCTC apresenta ações de angiogênese e remodelamento tecidual (p.ex. fibrose), sem ações imunológicas protetoras.

Os mastócitos foram descritos pela primeira vez em 1878 por Paul Ehrlich.22 São células imunes multifuncionais, de vida longa, originam-se na medula óssea, em resposta ao fator de célula tronco (ligante KIT), o qual é ligante do receptor transmembrana tirosina CD117, codificado pelo KIT. CD117 regula o crescimento, a migração, a sobrevivência e as funções efetoras dos mastócitos. Os progenitores subsequentemente migram do sangue para os vários tecidos incluindo pele, pulmões, interfaces mucosas, onde adquirem seus fenótipos específicos teciduais.23 Expressam em sua superfície uma variedade de moléculas de adesão que podem promover sua fixação às outras células, incluindo em particular as células endoteliais. Migram para os tecidos sob influência de citocinas, onde sofrem processo de maturação até adquirirem seu fenótipo final, de acordo com o microambiente. Por último, os mastócitos apresentam a característica de migrar para a superfície epitelial das mucosas após provocação antigênica.
São recrutados até a superfície das vias aéreas pelo fator de célula tronco (SCF) liberado pelas células epiteliais, os quais atuam nos receptores c-KIT expressos pelos mastócitos. O SCF desempenha papel crítico na diferenciação, proliferação e modulação de mastócitos humanos.24 Os mastócitos humanos respondem a ampla profusão de estímulos, incluindo fatores de crescimento, citocinas, nucleotídeos, complemento, lipídios, proteases, produtos de infecção (MCs humanos expressam todos os receptores TLR), poluentes, agentes ocupacionais, estímulos físicos, drogas e sinalização célula a célula.25 Entretanto, durante décadas a investigação da sinalização MC concentrou-se na IgE dependente de alérgenos ativação, através do receptor IgE de alta afinidade FceRI.
A maioria dos mastócitos nas vias aéreas está localizada abaixo do epitélio brônquico, mas um número considerável de células é encontrado inserido entre as células epiteliais e adjacente à superfície brônquica. Estas células em função de sua localização entrariam em contato imediato com os antígenos inalados, apresentando grande importância na modulação das fases iniciais da resposta alérgica.26
Nos pulmões, a reação antígeno induzida determina a liberação de  mediadores de um pequeno número de mastócitos localizados na luz brônquica, o que pode determinar aumento da permeabilidade local e aumentar a exposição antigênica aos mastócitos de localização mais profunda, como os da submucosa, os das glândulas mucosas e da musculatura lisa. No músculo liso das vias aéreas os mastócitos contribuem para sua hipertrofia e hiperplasia e contribuem para a hiper-responsividade brônquica (HRB). 27 Os mastócitos que se localizam perto das glândulas mucosas e submucosas onde a liberação de PGD 2, LTC 4, IL-4 e IL-13 podem desencadear maior produção de muco pelas células caliciformes. 28 Sua sobrevida varia de semanas a meses. Na mucosa das vias aéreas existem cerca de 20.000 mastócitos por mm 3 29,30 e representam 1–2% das células alveolares. (Figura 5) Provavelmente também proliferam nos tecidos.
A presença de mastócitos no músculo liso das vias aéreas é outra característica da asma, existindo uma correlação inversa entre o número de mastócitos na musculatura lisa brônquica e a
PC20 para metacolina nos indivíduos com asma.31 Outra doença pulmonar eosinofílica, a bronquite eosinofílica, apresenta inflamação na via aérea similar à da asma, incluindo a fibrose subepitelial, porém não manifesta à hiper-responsividade, tida como a principal característica da asma.
Os mastócitos exibem um fenótipo heterogêneo e isto tem sido demonstrado em função de sua aparência pois, tal como os basófilos, os mastócitos contêm grânulos ricos em proteoglicanos ácidos que absorvem corantes básicos. O proteoglicano dominante do mastócito humano é a heparina, que constitui mais de 75% do total, sendo o restante composto por uma mistura de condroitina sulfatos. O mastócito das mucosas contém a protease triptase e tem sido funcionalmente associado ao sistema imunológico e a reações de defesa do hospedeiro.
O mastócito é um componente essencial da imunidade inata e pode servir para amplificar a imunidade adaptativa. Os mastócitos podem responder a patógenos, como bactérias e vírus, por meio de múltiplos receptores do tipo Toll expressos em sua superfície celular. Por último deve ser ressaltado que mesmo um nível muito baixo de alérgenos é suficiente para desencadear a desgranulação do mastócito, que se inicia em segundos após a ligação ao antígeno, liberando uma série de mediadores pré-formados e recém-formados.
➢Receptor para IgE – Receptor de Alta Afinidade FcεRI
 O mastócito pode ser considerado como uma célula primária participante de reação alérgica precoce assim como de inflamação alérgica crônica. O mastócito pode ser considerado como uma célula primária participante de reação alérgica precoce assim como de inflamação alérgica crônica.
Possuem em sua superfície 10.000 – 100.000 receptores para a fração Fc da IgE.32 A IgE está fixada à membrana de mastócitos teciduais e basófilos circulantes,33,34 por um receptor tetrâmero de alta afinidade FcεRI (kD = 1-2 X 10-9 M).

A cadeia β com 263 aminoácidos transpõe a membrana celular quatro vezes e as duas cadeias γ com 86 aminoácidos se prolongam a considerável distância no citoplasma. O receptor FcεRI interage com os domínios CH3/CH3 e CH4/CH4 da molécula de IgE via dois domínios immunoglobulin-like da cadeia alfa. O FcεRI envolve um simples domínio Cε3, fazendo contato em ambos os lados ou interage com faces opostas do domínio Cε3 de um lado da IgE. As cadeias beta e gama estão envolvidas na transmissão de sinais que partem da superfície da célula, ocorrendo uma série de eventos na membrana e citoplasma (transdução de sinal, tradução e amplificação de sinal e ativação de proteínas alvos/efetoras) do mastócito, utilizando Ca2+ e mecanismos energia dependente. As cadeias β e γ possuem em seu domínio citoplasmático dois resíduos de tirosina ITAM. (Figura 7) Os receptores na fisiologia celular do mastócito cumprem um papel relevante, podendo atuar na sua ativação, maturação e proliferação.36
Ativação, Regulação, Degranulação e Apoptose dos Mastócitos –Mediação Via IgE
Os mastócitos são ativados pelo acoplamento do antígeno (ligação cruzada) (Figura 8) aos receptores IgE da superfície de sua membrana celular, resultando em agregação dos receptores FcεRI (alta afinidade para a região Fc da IgE) e através de uma sinalização intracelular, caracterizada pela fosforilação do ITAM (intracellular immunoreceptor tyrosine-based activation motif), domínios do receptor das cadeias -ß e -γ. A agregação ativa o signal-initiating kinase, LYN, que fosforila tirosinas nas subunidades FcεRI-ß e - γ, criando sítios de ligação para o signal-propagating-kinase, SYK. O recrutamento e a ativação do SYK determinam em minutos:
• A fosforilação da tirosina de várias proteínas de sinalização (isoformas da PLCγ (fosfolipase Cγ), PI3K (phosphatidylinositol 3-kinase), VAV, GRB2 (growth factor receptor bound protein 2), LAT (linker for activation of T cells), Cbl e muitas outras;
• A mobilização de estoques de Ca2+ intracelular e extracelular;
• Liberação de mediadores pela degranulação e
• Aumento da adesão mediada via integrinas e produção de citocinas (dentro de horas).
 Esta fosforilação ativa segundo mensageiros resultando na formação de canais de cálcio (Ca2+), determinando influxo de Ca2+ para dentro da célula. A entrada do cálcio ocasiona a formação do ácido araquidônico e promove a formação de microtúbulos que são necessários para o movimento de grânulos até a membrana plasmática. A ligação cruzada do FcεRI ativa também a adenilciclase, desencadeando um aumento transitório no AMPc. A proteína-quinase-AMPc dependente fosforila as proteínas da membrana, resultando em expansão de mais de 1.000 grânulos secretórios dos mastócitos (Figura 9) e liberação de mediadores inflamatórios, que desencadeiam os sintomas e sinais das reações alérgicas. Os mastócitos sobrevivem à degranulação e refazem os estoques de mediadores nos grânulos secretórios. Esta fosforilação ativa segundo mensageiros resultando na formação de canais de cálcio (Ca2+), determinando influxo de Ca2+ para dentro da célula. A entrada do cálcio ocasiona a formação do ácido araquidônico e promove a formação de microtúbulos que são necessários para o movimento de grânulos até a membrana plasmática. A ligação cruzada do FcεRI ativa também a adenilciclase, desencadeando um aumento transitório no AMPc. A proteína-quinase-AMPc dependente fosforila as proteínas da membrana, resultando em expansão de mais de 1.000 grânulos secretórios dos mastócitos (Figura 9) e liberação de mediadores inflamatórios, que desencadeiam os sintomas e sinais das reações alérgicas. Os mastócitos sobrevivem à degranulação e refazem os estoques de mediadores nos grânulos secretórios.
Publicações indicam que o monômero da IgE (ausência de acoplamento em ligação cruzada) pode tornar o mastócito resistente à apoptose induzida pela privação de fatores de crescimento in vitro e, sob certas circunstâncias, pode induzir à liberação de citocinas. Desta forma o acoplamento da IgE ao FcεRI pode influenciar a sobrevivência do mastócito direta ou indiretamente, podendo também regular a função celular. A ligação monomérica da IgE ao FcεRI aumenta a expressão do FcεRI na superfície, a qual está associada ao aumento da sensibilidade ao estímulo antigênico e ao aumento da produção de mediadores e citocinas após o acoplamento.37
Dependendo das circunstâncias, o acoplamento no FcεRI pode aumentar a sobrevivência ou a proliferação dos mastócitos, promover a apoptose ou não ter consequências na sobrevivência. As decisões sobre a sobrevivência ou morte dos mastócitos são influenciadas por vários fatores endógenos ou exógenos. Os fatores endógenos incluem as citocinas secretadas pela própria célula, receptores de citocinas, moléculas de adesão, caspases, proteínas da família BCL-2, moléculas de sinalização intracelular (proteínas e lipídios) e fatores de transcrição.
Os grânulos secretórios dos mastócitos contêm um complexo cristalino de mediadores pré-formados, ionicamente ligados à matriz de proteoglicanos. Quando os mastócitos são ativados, os grânulos se expandem e movem-se em direção à membrana celular. Após a fusão dos grânulos com a membrana celular, o conteúdo granular perde a natureza cristalina, o complexo se torna solúvel e os mediadores como a histamina, as proteases e os proteoglicanos são liberados para o ambiente extracelular por um processo de difusão passiva, chamado de exocitose. (Figura 9)
 Figura 10 >> Vias de Ativação Mediadas por FcεRI (link). Figura 10 >> Vias de Ativação Mediadas por FcεRI (link).
O mediador mais conhecido dos mastócitos é a histamina, que se encontra presente nos grânulos em concentrações de 100 nmol/l, equivalente a 1–4 pg por célula, dependendo do número de grânulos presentes. A histamina participa na reação alérgica imediata, desenvolvendo vasodilatação com aumento da permeabilidade vascular, contração da musculatura lisa brônquica e intestinal, e aumento da secreção de muco. Sua ação é curta pois a histamina é rapidamente metabolizada em 1–2 minutos, sendo 70% metabolizados pela histamina N-metiltransferase e 30% pela diamina oxidase (histaminase). Os efeitos da histamina dependem do tipo de receptor encontrado nos tecidos: H1 – contração do músculo liso, H2 – dilatação dos vasos sanguíneos, H3 – inibição da liberação da noradrenalina e H4 – pode estar envolvido na patogênese da alergia e inflamação, ativando as células Th2 e Th17.38
Na atualidade credita-se aos mastócitos um papel bastante relevante na orquestração das respostas inflamatórias alérgicas pois, além do exposto, os mastócitos tanto em roedores como em humanos expressam moléculas do complexo principal de histocompatibilidade (MHC),39-41 podendo ter participação na apresentação de antígenos às células T secretando IL-4 e IL-13, podem manifestar potencial influência na produção de IgE pelos linfócitos B;42,43 e são também capazes de regular a diferenciação celular Th2.44,45 Os mastócitos podem causar mudanças estruturais via produção de laminina, colágeno IV e ativação de fibroblastos.
A ativação de mastócitos pulmonares humanos libera um vasto arsenal de mediadores lipídicos pré-formados e recentemente sintetizados, citocinas, quimiocinas, fatores angiogênicos e linfangiogênicos.46,47 (Tabela 1)
Tabela 1 – Mediadores Liberados pelos Mastócitos
Pré-formados |
| Histamina |
|
| Quimase |
β-triptase |
| Carboxipeptidase A3 |
Catepsina G |
| Metaloproteinase de Matriz (MMPS) |
Granzima B |
| Heparina |
Condroitina Sulfato |
Mediadores Lipídicos |
| Leucotrienos – LTC4, LTD4, LTE4 |
Prostaglandina D2 (PGD2) |
| Tromboxanos |
Fator de Ativação Plaquetária (PAF) |
Citocinas |
| Fator de Célula Tronco (SCF) |
Fator de Necrose Tumoral-α (TNF-α) |
|
|
| IL-1β, IL-3, IL-4, IL-5, IL-6 |
IL-9, IL-10, IL-11, IL-13 |
|
|
| IL-16, IL-22, IL25/17E |
Linfopoietina Estromal Tímica (TSLP) |
|
|
| Fator Estimulante de Colônias de Granulócitos e Macrófagos (GMCSF) |
Fator de Crescimento Endotelial Vascular (VEGF) |
| Fator de Crescimento Neural (NGF) |
Fator de Crescimento de Fbroblastos- 2 (FGF-2) |
| Anfiregulina |
|
Quimiocinas |
| CXCL8/IL-8, CCL1/I-309 |
CXCL10/IP-10 |
| CCL2/MCP-1 |
CXCL1/GRO-α |
| CCL3/MIP-1α |
|
Fatores Angiogênicos |
| VEGF-A |
|
| |
|
| Angiopoietinas (ANGPT1 e ANGPT2) |
VEGF-C, VEGF-D |
| |
|
Fatores Linfangiogênicos |
| VEGF-C, VEGF-D |
Neuromediadores |
| Serotonina |
Substância P |
O lavado broncoalveolar, na fase precoce da asma,48 demonstra aumento das concentrações principalmente de triptase, histamina, LTC4, LTD4, LTE4, PGD2, PGF2 (9-a, 11-ß) e tromboxane, todos potentes broncoconstritores, e que determinam também aumento da permeabilidade vascular, aumento da produção de muco e estimulação nervosa aferente.
Mastócitos secretam ADN mitocondrial, com ações estimulatórias autócrinas e parácrinas. Como foi citado acima, os mastócitos liberam leucotrienos, prostaglandinas, fator de atividade plaquetária, citocinas e quimiocinas (CXCL8, CCL2 e CCL5).
O que até aqui foi descrito configura a resposta imediata que ocorre entre 10 e 15 minutos após exposição ao antígeno e que geralmente se resolve em duas horas. Um segundo período de broncoconstrição ocorre em 30 a 70% dos pacientes e configura a resposta asmática tardia, que se inicia 3 a 4 horas após a inalação, podendo durar mais de 24 horas. (Figura 11)

Referências
01.Mitchell PD, O'Byrne PM. Epithelial-derived cytokines in asthma. Chest 2017;151: 1338–1344.
02.Wang W, Li Y, Lv Z, et al. Bronchial allergen challenge of patients with atopic asthma triggers an alarmin (IL-33, TSLP, and IL-25) response in the airways epithelium and submucosa. J Immunol 2018; 201:2221–2231.
03.Han H, Headley MB, Xu W, Comeau MR, Zhou B, Ziegler SF. Thymic stromal lymphopoietin amplifies the differentiation of alternatively activated macrophages. J Immunol 2013;190:904-12.
04.Pattarini L, Trichot C, Bogiatzi S, Grandclaudon M, Meller S, Keuylian Z, Durand M, Volpe E, Madonna S, Cavani A, Chiricozzi A, Romanelli M, Hori T, Hovnanian A, Homey B, Soumelis V. TSLP-activated dendritic cells induce human T follicular helper cell differentiation through OX40-ligand. J Exp Med 2017; 214:1529-1546.
05.Salter BM, Oliveria JP, Nusca G, Smith SG, Watson RM, Comeau M, Sehmi R, Gauvreau GM. Thymic stromal lymphopoietin activation of basophils in patients with allergic asthma is IL-3 dependent. J Allergy Clin Immunol 2015; 136:1636-1644.
06.Cook EB, Stahl JL, Schwantes EA, Fox KE, Mathur SK. IL-3 and TNFa increase Thymic Stromal Lymphopoietin Receptor (TSLPR) expression on eosinophils and enhance TSLP-stimulated degranulation. Clin Mol Allergy 2012; Jul 28;10(1):8.
07.Lambrecht BN. Allergen uptake and presentation by dendritic cells. Curr Opin Allergy Clin Immunol 2001; 1:51-9.
08.Hammad H, Lambrecht BN. The basic immunology of asthma. Cell 2021; 184:1469-1485.
09.Smith WB, Holt PG. – Professional antigen-presenting cells. In : William W. Busse & Stephen T. Holgate. Asthma & Rhinitis 1. Oxford: Blackwell Science Ltd; 2000:650-670.
10.Sears MR, Burrows B, Flannery EM, Herbison GP, Hewitt CJ, Holdaway MD. Relation between airway responsiveness and serum IgE in children with asthma and in apparently normal children. N Engl J Med 1991; 325:1067-71.
11.Siraganian RP. Mast cell signal transduction from the high-affinity IgE receptor. Curr Opin Immunol . 2003; 15:639-646.
12.Del Prete GF, Maggi E, Parronchi P, Chretien I, Tiri A, Maccgia D et al. IL-4 is an essential factor for the IgE synthesis induced in vitro by human T cell clones and their supernatants. J Immunol 1988; 140:4193-8.
13.Punnonen J, Aversa G, Cocks BG, McKenzie ANJ, Menon S, Zurawski G, de Waal Malefyt R, de Vries JE. Interleukin 13 induces interleukin 4-independent IgG4 and IgE synthesis and CD23 expression by human B cells. Proc Natl Acad Sci USA 1993; 90:3730-4.
14.Parronchi P, Tiri, A, Macchia D, De Carli M, Biswas P, Simonelli, C, Maggi E, Del Prete GF, Ricci M, Romagnani S. Noncognate contact-dependent B cell activation can promote IL-4-dependent in vitro human IgE synthesis. J Immunol 1990; 144:2102-8.
15.Jabara HH, Fu SM, Geha RS, Vercelli D. CD40 and IgE: synergism between anti-CD40 monoclonal antibody and interleukin 4 in induction of IgE synthesis by highly purified human B cells. J Exp Med 1990; 172:1861-4.
16.Fuleihan R, Ramesh N, Loh R, Jabara HH, Rosen FS, Chatila T, Fu SM, Stamenkovic I, Geha RS. Defective expression of the CD40 ligand in X chromosome-linked immunoglobulin deficiency with normal or elevated IgM. Proc Natl Acad Sci USA 1993; 90:2170-3.
17.Manise M, Holtappels G, Van Crombruggen K, Schleich F, Bachert C, Louis R. Sputum IgE and cytokines in asthma: relationship with sputum cellular profile. PLoS One 2013; 8:e58388.
18.Redhu NS, Gounni AS. The high affinity IgE receptor (FceRI) expression and function in airway smooth muscle. Pulm Pharmacol Ther 2013; 26:86-94.
19.Sutton BJ, Gould HJ. The Human IgE Network. Nature 1993, 366:421-8.
20.Sutton. BJ, Beavil AJ, Beavil R, Hunt, J. —IgE and IgE Receptors. In A.B.Kay, J.Bousquet, P.G.Kaplan. Allergy and Allergic Diseases. Vol 1 The Scientific Basis of Allergy. Hoboken NJ; 2008:10-18.
21.Igarashi Y, Goldrich MS, Kaliner MA, Irani AMM, Schwartz LB, White MV. Quantification of inflammatory cells in the nasal mucosa of allergic rhinitis and normal subjects. J Allergy Clin Immunol 1995; 95:716.
N Engl J Med 2015; 373:163-172.
22.Ehrlich, P. Beitrage sur Theorie und Praxis der Histologischen Farbung. Ph.D. Thesis, University of Leipzig, Leipzig, Germany, 1878.
23.Theohatides TC, Valent P, Akin C. Mast cells, mastocytosis, and related disorders. N Engl J Med 2015; 373:163-172.
24.Tsai M, Valent P, Galli SJ. KIT as a master regulator of the mast cell lineage. J Allergy Clin Immunol 2022; 149:1845-1854.
25.Bradding P, Arthur G. Mast cells in asthma--state of the art. Clin Exp Allergy 2016; 46:194-263.
26.Altman MC, Lai Y, Nolin JD, Long S, Chen CC, Piliponsky AM, Altemeier WA, Larmore M, Frevert CW, Mulligan MS, Ziegler SF, Debley JS, Peters MC, Hallstrand TS. Airway epithelium-shifted mast cell infiltration regulates asthmatic inflammation via IL-33 signaling. J Clin Invest 2019; 129:4979-4991.
27.Elieh Ali Komi D, Bjermer L. Mast Cell-Mediated Orchestration of the Immune Responses in Human Allergic Asthma: Current Insights. Clin Rev Allergy Immunol 2019; 56:234-247.
28.Carter RJ, Bradding P. The role of mast cells in the structural alterations of the airways as a potential mechanism in the pathogenesis of severe asthma. Curr Pharm Des 2011; 7:685-98.
29.White MV, Kaliner MA. Mast cells and asthma. In:Asthma: Its Pathology and Treatment. Edited by Kaliner MA, Persson C, Barnes P, New York: Marcel Dekker; 1990-409-440.
30.Kaline MA. Pathogenesis of asthma. In: Clinical Immunology: Principles and Practice. Edited by Rich RR. St Louis: Mosby; 1996;909-923.
31.Brightling CE, Bradding P, Symon FA, Holgate ST, Wardlaw AJ, Pavord ID. Mast-cell infiltration of airway smooth muscle in asthma. N Engl J Med 2002; 346:1699-705.
32.Wasserman SI. Mast cell-mediated inflammation in asthma. Ann Allergy 1989; 636:546-50.
33.MacGlashan DW Jr, Bochner BS, Adelman DC et al. Down-regulation of Fc(epsilon)RI expression on human basophils during in vivo treatment of atopic patients with anti-IgE antibody. J Immunol 1997; 158:1438-45.
34.Galli SJ. The Paul Kallos Memorial Lecture: the mast cell: a versatile effector cell for a challenging world. Int Arch Allergy Immunol 1997; 113:14-22.
35.Sears MR, Burrows B, Flannery EM, Herbison GP, Hewitt CJ, Holdaway MD. Relation between airway responsiveness and serum IgE in children with asthma and in apparently normal children. N Engl J Med 1991; 325:1067-71.
36.Siraganian RP. Mast cell signal transduction from the high-affinity IgE receptor. Curr Opin Immunol . 2003; 15(6):639-646. doi:10.1016/j.coi.2003.09.010.
37.Kawakami T, Galli SJ. Regulation of mast-cell and basophil function and survival by IgE. Nat Rev Immunol 2002; 2:773-86.
38.Thangam EB, Jemima EA, Singh H, Baig MS, Khan M et al. The role of histamine receptors in mast cell-mediated allergy and inflammation: The hunt for new therapeutic targets. Front Immunol;2018; 9:1873, doi: 10.3389/fimmu2018.01873.
39.Reshef A, MacGlashan DW. Immunogold probe for the light-microscopic phenotyping, of human mast cells and basophils. J Immunol Methods 1987; 99:213-9.
40.Suzumura Y, Ohasi M. Immunoelectron microscopic localization of HLA-DR antigen on mast cells and vessels in normal and tuberculin-reactive skin. Am J Dermatopathol 1991; 13:568-74.
41.Love KS, Lakshmanan RR, Butterfield JH, Fox CC. IFN-gamma-stimulated of MHC class II antigen expression by the human mast cell line HMC-1. Cell Immunol 1996; 170:85-90.
42.Gauchat JF, Henchoz S, Mazzei D et al. Induction of human IgE synthesis in B cells by mast cells and basophils. Nature 1993; 365:340-3.
43.Pawankar R, Okuda M, Yssel H, Okumura K, Ra C. Nasal mast cells in perennial allergic rhinitis exhibit increased expression of the FceRI, CD40L, IL-4 and IL-13, and can induce IgE synthesis in B cells. J Clin Invest 1997; 99:1492-9.
44.Bradding P, Feather IH, Howarth PH, Mueller R, Roberts JA, Britten K, Bews JP, Hunt TC, Okayama Y, Heusser CH, et al.
Interleukin 4 is localized to and released by human mast cells. Journal of Experimental Medicine 1992; 176:1381-6.
45.Huels C, Germann T, Goedert S, Hoehn P, Koelsch S, Hültner L, Palm N, Rüde E, Schmitt E. Co-activation of naïve CD4+ T cells and bone marrow-derived mast cells results in the development of Th2 cells. Int Immunol 1995; 7:525-32.
46.Poto R, Criscuolo G, Marone G, Brightling CE, Varricchi G. Human Lung Mast Cells: Therapeutic Implications in Asthma. Int J Mol Sci 2022 Nov 21; 23(22):14466.
47.Varricchi G, Raap U, Rivellese F, Marone G, Gibbs BF. Human mast cells and basophils-How are they similar how are they different? Immunol Rev 2018; 282:8-34.
48.Kavuru MS, Raed A, Dweik MD, Thomassen MJ. Role of bronchoscopy in asthma research. Clin Chest Med 1999; 20:153-83.
|